Khi đốt cháy P trong khí oxi người ta thấy cứ 1 gam P kết hợp đủ với khoảng 1,29 gam khí oxi tạo ra một hợp chất A duy nhất . Xác định công thức hóa học của A và hóa trị của P trong hợp chất , biết rằng phân tử A có 2 nguyên tử P
( ko dùng mol tại em chưa học ạ )
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a
Gọi chất đó là X
Sơ đồ phản ứng:\(X+O_2\rightarrow CO_2+H_2O\)
Áp dụng định luật bảo toàn khối lượng:
\(m_X+m_{O_2}=m_{CO_2}+m_{H_2O}\)
\(\Rightarrow m_X=m_{CO_2}+m_{H_2O}-m_{O_2}=8,8+3,6-6,4=6\left(g\right)\)
\(n_{CO_2}=\frac{m}{M}=\frac{8,8}{44}=0,2\left(mol\right)\Rightarrow n_{C\left(X\right)}=n_{CO_2}=0,2\left(mol\right)\)\(\Rightarrow m_C=n.M=0,2\cdot12=2,4\left(g\right)\)
\(n_{H_2O}=\frac{m}{M}=\frac{3,6}{18}=0,2\left(mol\right)\Rightarrow n_{H\left(X\right)}=2n_{H_2O}=0,4\left(mol\right)\Rightarrow m_H=0,4\left(g\right)\)
Ta có:\(m_C+m_H=2,4+0,4=2,8< 6\) nên X có oxi
\(m_{O\left(X\right)}=6-2,8=3,2\left(g\right)\Rightarrow n_{O\left(X\right)}=\frac{m}{M}=\frac{3,2}{16}=0,2\left(mol\right)\)
Gọi CTHH của X là \(C_xH_yO_z\left(x,y,z\inℕ^∗\right)\)
Ta có:\(x:y:z=0,2:0,4:0,2=1:2:1\)
\(\Rightarrow x=1;y=2;z=1\)
\(\Rightarrow CTHHdongiannhat:CH_2O\)
b
CTHH \(\left(CH_2O\right)_n\left(n\inℕ^∗\right)\)
Ta có:\(\left(12+2+16\right)n=60\)
\(\Rightarrow n=2\)
Vậy CTHH của hợp chất là \(C_2H_4O_2\)
P/S:Không chắc

a, \(n_{O_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Theo ĐLBT KL, có: mX + mO2 = mCO2 + mH2O
⇒ m = mX = 13,2 + 7,2 - 0,45.32 = 6 (g)
Ta có: \(n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{7,2}{18}=0,4\left(mol\right)\Rightarrow n_H=0,4.2=0,8\left(mol\right)\)
⇒ mC + mH = 0,3.12 + 0,8.1 = 4,4 (g) < mX
→ X gồm C, H và O.
⇒ mO = 6 - 4,4 = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Gọi CTPT của X là CxHyOz
⇒ x:y:z = 0,3:0,8:0,1 = 3:8:1
Vậy: CTPT của X là C3H8O
b, \(C_3H_8O+\dfrac{9}{2}O_2\underrightarrow{t^o}3CO_2+4H_2O\)

Tham khảo
a) Phân tử khối của X : 2 . 32 = 64 đvC
b) Theo đề cho ta có
2X + 1.O = 64
=> 2X = 64 - 16 = 48
=> X = 24
Vật X là nguyên tố Mg
Câu 1a, đề ghi là tính nguyên tử khối á nên mình không biết áp dụng như thế nào. Và đề này mình thấy không giống phần tham khảo.

Gọi công thức phân tử của A, B là C x H y O
Phương trình hoá học:
C x H y O + (x +y/4 -1/2) O 2 → x CO 2 + y/2 H 2 O
n CO 2 = 17,6/44 = 0,4 mol; n H 2 O = 9/18 = 0,5 mol (1)
m C = 0,4.12 = 4,8 gam; m H = 0,5.2 = 1g (2)
Từ (1), (2)
→ x : y : 1 = 4,8/12 : 1/1 : 1,6/16 = 0,4 : 1 : 0,1
Vậy m O = 7,4 - 4,8 - 1,0 = 1,6 (gam)
=> Công thức phân tử của A, B là C 4 H 10 O
Ta có M A , B = 74 (g/mol)
n A , B = 7,4/74 = 0,1 mol
Khi phản ứng với Na có khí bay ra → trong A, B có nhóm OH.
Phương trình hoá học :
C 4 H 9 OH + Na → C 4 H 9 ONa + 1/2 H 2
Vậy số mol có nhóm OH là 2 n H 2 = 2. 0,672/22,4 = 0,06 < n A , B
→ trong A, B có 1 chất không có nhóm OH → Cấu tạo tương ứng là
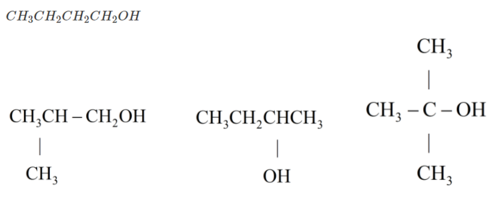
Chất không có nhóm OH :
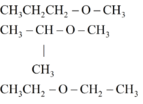

Biết 1 lít hỗn hợp A ở dạng khí nặng gấp hai lần 1 lít khí C 2 H 6 ở cùng điều kiện.
⇒ n A = n C 2 H 6 ⇒ M A = 2 M C 2 H 6
(cùng điều kiện nên tỉ lệ thể tích chính là tỉ lệ số mol)
Ba chất có cùng công thức phân tử ⇒ có cùng khối lượng mol phân tử : M = 2.30 = 60 (gam/mol). Khi đốt cháy hỗn hợp A thu được CO 2 , H 2 O → công thức phân tử của các chất có dạng C x H y O z
Phương trình hoá học
C x H y O z + (x + y/4 - z/2) O 2 → x CO 2 + y/2 H 2 O
CO 2 + Ca OH 2 → Ca CO 3 + H 2 O
Ta có : n CO 2 = n CaCO 3 = 15/100 = 0,15mol
Theo định luật bảo toàn khối lượng, ta có :
m A + m O = m CO 2 + m H 2 O
⇒ 3 + 7,2 = 0,15 x 44 + m H 2 O ⇒ m H 2 O = 3,6g
n A = 3/60 = 0,05mol; n CO 2 = 0,05x = 0,15 ⇒ x = 3
n H 2 O = 0,05y/2 = 3,6/18 ⇒ y = 8
M A = 12x + y + 16z = 60 ⇒ z = 1 ⇒ ông thức phân tử của A là C 3 H 8 O
Công thức cấu tạo của ba chất là : CH 3 CH 2 CH 2 OH
CH 3 CHOH CH 3
CH 3 -O- CH 2 CH 3

a) Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Bảo toàn H: \(n_H=2n_{H_2O}=2.\dfrac{1,35}{18}=0,15\left(mol\right)\)
Bảo toàn O: \(n_O=\dfrac{1,15-0,05.12-0,15}{16}=0,025\left(mol\right)\)
=> A có chứa C, H và O
PTHH: \(C_xH_yO_z+\left(x+\dfrac{y}{4}-\dfrac{z}{2}\right)O_2\underrightarrow{t^o}xCO_2+\dfrac{y}{2}H_2O\)
b) CTPT của A có dạng CxHyOz
=> x : y : z = 0,05 : 0,15 : 0,025 = 2 : 6 : 1
\(\rightarrow\left(C_2H_6O\right)_n=1,4375.32=46\left(\dfrac{g}{mol}\right)\)
=> n = 1
CTPT: C2H6O

HD:
Gọi CTHH của X là CxHyOz.
CxHyOz + (x + y/2 - z/4)O2 ---> xCO2 + y/2H2O
Số mol O2 = 10,08/22,4 = 0,45 mol. Khối lượng O2 = 32.0,45 = 14,4 g.
Áp dụng ĐLBTKL ta có: m + 14,4 = 13,2 + 7,2 (m là khối lượng của X). Thu được: m = 6 g.
Khối lượng C = 12.13,2/44 = 3,6 g; Khối lượng H = 2.7,2/18 = 0,8 g; khối lượng O = 6 - 3,6 - 0,8 = 1,6 g.
Như vậy: 12x:y:16z = 3,6:0,8:1,6 hay x:y:z = 0,3:0,8:0,1 = 3:8:1. suy ra X có CT: C3H8O.
Hỗn hợp có tỉ khối H2 14.75
=> Khối lượng trung bình hh là : 14.75*2 =29.5
Ta có:
O2 (32)..............1.5
..............29.5
N2 (28)...............2.5
Vậy O2/N2 = 1.5 / 2.5 = 0.6
2)
A + O2 ---> CO2 + H2O
Trong A chắc chắn có C và H :
số mol CO2 = 0.3 mol => nC = 0.3 ; nO = 0.6
Số mol H2O = 0.4 mol => nH = 0.8 ; nO = 0.4
Số mol O2 = 0.45 mol => nO = 0.9
....
Tổng số mol Nguyên Tử O trong Sản Phẩm là : 0.6 + 0.4 =1 > 0.9
Vậy là Trong A có Nguyên tố O
1 - 0.9 = 0.1 mol
....
Coi Công thức A : CxHyOz thì ta có tỉ lệ
x : y : z = 0.3 : 0.8 : 0.1 = 3 : 8 :1
Vậy Công thức A là : C3H8O
$n_P = \dfrac{1}{31}(mol)$
$n_{O_2} = \dfrac{1,29}{32} \Rightarrow n_O = 2n_{O_2} = \dfrac{2,58}{32}(mol)$
Suy ra :
$n_P : n_O = \dfrac{1}{31} : \dfrac{2,58}{32} = 2 :5$
Vậy A là $P_2O_5$
hóa trị của P : hóa tri V
em ghi là ko dùng mol rùi mà tại em chưa học mol :(((