trộn 500 ml dung dịch chứa hỗn hợp HCl 0,1M và H2SO4 0,1M với v ml chứa Ba(OH)2 0,1M . Phản ứng vừa đủ , trung hòa . Tính V , nồng độ mol của các ion trong dung dịch sau phản ứng , khối lượng chất rắn thu được .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nH+=0,04 mol nOH-=0,03 mol
H+ + OH- --------> H20
0,04 0,03
0,03 0,03 0,03
0,01
a/ [H+] du=0,01/0,2=0,05 M
[SO42-]=0,01/0,2=0,05 M
[K+]=0,01/0,2=0,05 M
[Ba2+]=0,01/0,2=0,05M
b/ nH+ du=0,01/0,2=0,05 M
pH=-log(0,05)=1,3
c/ khoi luong chat ran thu duoc sau phan ung la
mcr= mSO42- + mK+ + mBa2+
=0,01.96+0,01.39+0,01.137
=2,72g
ta có : \(\Sigma n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,04\left(mol\right)\)
\(\Sigma n_{OH^-}=n_{KOH}+2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(n_{SO_4^{2-}}=0,01\left(mol\right)\) ; \(n_{Ba^{2+}}=0,01\left(mol\right)\)
a, PT : \(H^++OH^-\rightarrow H_2O\)
0,03 0,03 0,03 (mol)
\(\Rightarrow n_{H^+}dư=0,01\left(mol\right)\)
đến đây tự tính đc nha. dùng ct \(CM=\dfrac{n}{V}\)
b, \(PH=-log[H^+]=-log\left(\dfrac{0,01}{0,2}\right)\simeq1,3\)
c, \(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
0,01 0,01 0,01 (mol)\(mcr=m\downarrow+m_{K^+}=m_{BaSO_4}+m_{K+}=\left(0,01\times233\right)+\left(0,01\times39\right)=2,72\left(g\right)\)

a) trong 100 ml dung dịch HCl và H2SO4
CM[H+]=[Cl-]=0,02 M
[SO4 2-]=0,01M
[H+] =2.0,01=0,02 M
trong 100ml dung dịch KOH và Ba(OH)2
[K+]=[OH-]=0,01M
[Ba2+]=0,01M
[OH-]=0,02M
b)n(H+)=0,02+0,02=0,04mol
n(OH-)=0,01+0,02=0,03mol
khi trộn : H+ + OH- =>H2O
0,03<--0,03
=> nH+ dư=0,01mol
=> [H+]=0,05M
=> pH=-lg(0,05)=1,3

a, \(2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
b, \(n_{HCl}=0,06.0,1=0,006\left(mol\right)\)
Theo PT: \(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{HCl}=0,003\left(mol\right)\)
\(\Rightarrow V_{Ba\left(OH\right)_2}=\dfrac{0,003}{0,2}=0,015\left(l\right)=15\left(ml\right)\)
c, \(n_{BaCl_2}=\dfrac{1}{2}n_{Ba\left(OH\right)_2}=0,003\left(mol\right)\Rightarrow C_{M_{BaCl_2}}=\dfrac{0,003}{0,06+0,015}=0,04\left(M\right)\)

Đáp án C
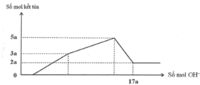
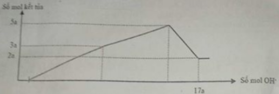
Nhận thấy sau 1 thời gian mới bắt đầu xuất hiện kết tủa → chứng tỏ trong dung dịch chứa H+ dư
Dựa vào đồ thị tại 17a mol OH- kết tủa không đổi → chỉ chứa Mg(OH)2 : 2a mol → nMg= 2a mol
Lượng kết tủa cực đại chứa Mg(OH)2 : 2a mol, Al(OH)3 : 3a mol → nAl2O3 = 1,5a mol
→ 2a. 24+ 1,5a . 102 = 12, 06 → a = 0,06 mol
Gọi số mol của HCl và H2SO4 lần lượt là0,5b và 0,1b
Dung dịch X chứa Mg2+ : 0,12 mol, Al3+ : 0,18 mol, Cl-:0,5b mol, SO42- :0,1b mol H+ dư : 0,7b- 0,78 ( bảo toàn điện tích)
Tại thời điểm 17a mol OH- thì nOH- = 4nAl3+ + 2nMg2+ + nH+ dư → 17. 0,06 = 4. 0,18 + 2.0,12 + 0,7b- 0,78 → b = 1,2
Khi thêm :
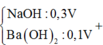


Kết tủa cực đại khi chưa ra sự hòa tan kết tủa thì nOH- = nH+ dư + 2nMg2+ + 3nAl3+ = 0,84
→ 0,5V = 0,84 → V = 1,68 lít → nBa2+ = 0,168 mol
Khi đó nBaSO4 = nSO42- = 0,12 mol
Chất rắn khan chứa BaSO4:0,12 mol; MgO: 0,12 mol; Al2O3: 0,09 mol → m = 41,94 gam

\(n_{HCl}=0,1.0,2=0,02\left(mol\right)\)
Pt : \(2HCl+Ca\left(OH\right)_2\rightarrow CaCl_2+2H_2O\)
0,02---->0,01---------->0,01
a) Nồng độ mol đề cho rồi mà nhỉ
b) \(m_{muôi}=m_{CaCl2}=0,01.111=1,11\left(g\right)\)

Đáp án B
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam






nH+=0,15 mol
nOH- = 0,2V mol
H+ + OH-------->H2O
0,15 0,15
0,15=0,2V=>V=0,75 l
[H+]=0,15/1,25=0,12M
[Cl-]=(0,1.0,5)/1,25=0,04
[Oh-]=0,15/1,25=0,12
[So42-]=0,05/1,25=0,04
Khoi luong chat ran
Ba2+ + So42---------->BaSO4
0,075 mol 0,05mol 0,05 mol
mbaso4=0,05.233=11,65g
1,25 ở đâu ra vậy bn ?
tại sao SO4 =0,05M ?
tại sao \(\left[Cl^-\right]=\frac{0,1\times0,5}{1,25}\) ?