Hoà tan hết hỗn hợp X gồm oxit của một kim loại có hoá trị II và muối cacbonat của kim loại đó bằng H2SO4 loãng vừa đủ, sau phản ứng thu được sản phẩm gồm khí Y và dung dịch Z. Biết lượng khí Y bằng 44% lượng X. Đem cô cạn dung dịch Z thu được một lượng muối khan bằng 168% lượng X. Hỏi kim loại hoá trị II nói trên là kim loại gì? Tính thành phần phần trăm của mỗi chất trong hỗn hợp X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: MO + H2SO4 ---> MSO4 + H2O
a a
MCO3 + H2SO4 ---> MSO4 + H2O + CO2
b b b
Chọn b=1 => khối lượng CO2 = 44g => mA = 100g => mMSO4 = 168g
(M + 16)a + (M + 60)b = 100 (1)
(M + 96)(a + b) = 168 (2)
Thế b=1 vào (1) và (2) => a = 0,4 mol ; M = 24 (kim loại Mg)
%MO = (40*0,4/100)*100= 16%
%MCO3 = 100% -16% = 84%
Vậy kim loại 2 là mg và khối lượng hóa học x là 84 %

Bài này tương tự, tham khảo.
Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168% lượng A. Biết khối lượng khí B bằng 44% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài làm
Gọi kim loại hóa trị II là R, có nguyên tử khối là R (R > 0), x là số mol của RO (x > 0)
Theo bài ra ta có các PTHH :
RO + H2SO4 \(\rightarrow\) RSO4 + H2O
RCO3 + H2SO4 \(\rightarrow\) RSO4 + CO2\(\uparrow\) + H2O
Giả sử khối lượng của A đem tham gia p.ứng là 100g thì khối lượng RSO4 = 168g và khối lượng CO2 = 44g \(\approx\) 1 mol.
Theo giả sử ta có : (R + 16)x + R + 60 = 100 (1)
Theo phương trình ta có : (R + 96)x + R + 96 = 168 (2)
Từ (1), (2) \(\Rightarrow\) x = 0,4
R \(\approx\) 24 \(\Rightarrow\) Mg
Phần trăm khối lượng của oxit là : %MgO = 16%
Phần trăm khối lượng của muối là : %MgCO3 = 84%
chép mạng . Không tính. Mới có lớp 7 làm sao nổi hóa lớp 8 chứ không ns đến lớp 10

Gọi công thức oxit của kim loại hóa trị III là A2O3,ta có các phương trình sau
A2O3+3H2SO4--->A2(SO4)3+3H2O (1)
0,02<--0,06<---------0,02
Vì sau phản ứng (1) dung dịch còn có thể phản ứng với CaCO3 giải phóng khí CO2=>axit H2SO4 dư,ta có phương trình
H2SO4+CaCO3--->CaSO4+CO2+H2O (2)
0,01<-----0,01--------0,01<-----0,01
nCO2=0,224:22,4=0,01 mol
Khối lượng muối A2(SO4)3 sau khi cô cạn là
9,36-0,01x(40+96)=8 g
Ta thấy rằng A2O3=3,2 g,sau phản ứng tạo thành muối A2(SO4)3=8g Như vậy khối lượng tăng thêm là do 3 gốc -SO4 thay thế cho 3 nguyên tử Oxi,vậy khối lượng tăng thêm là 8-3,2 =4,8 g
nA2SO4=4,8:(96x3-16x3)=0,02 mol
=>khối lượng muối=0,02x(2xR+96x3)=8
=>R=56
R hóa trị III, có M=56=>R là Fe,công thức oxit là Fe2O3
nH2SO4=0,01+0,06=0,07 mol
mH2SO4=0,07x98=6,86g
C% đ H2SO4=(6,86:200)x100%=3,43%

Chọn đáp án A.
Hỗn hợp khí gồm H2 và NO.
⇒ n H 2 + n N O = 0 , 896 22 , 4 = 0 , 04 m o l 2 n H 2 + 30 n N O = 0 , 04 . 8 . 2 = 0 , 64 g
⇒ n H 2 = 0 , 02 m o l n N O = 0 , 02 m o l
→ B T N T N n N a N O 3 = n N O = 0 , 02 m o l
· Z + 0,54 mol NaOH:
→ B T N T N a n N a 2 S O 4 = 0 , 28 m o l
⇒ n H 2 S O 4 = 0 , 28 m o l
⇒ m X = 11 , 92 gam
n H + = 3 n N O + 3 n H 2 + n N O + 2 n O = 0 , 56 m o l
⇒ n O = 0 , 56 - 4 . 0 , 02 - 2 . 0 , 02 2 = 0 , 22 m o l
⇒ m = 15 , 44 gam
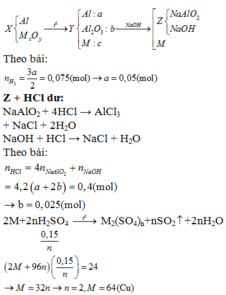
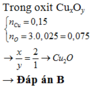




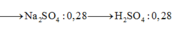
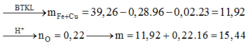
RO+H2SO4→ RSO4+H2ORO+H2SO4→ RSO4+H2O (1)
RCO3+H2SO4→ RSO4+CO2+H2ORCO3+H2SO4→ RSO4+CO2+H2O (2)
Đặt a là khối lượng hỗn hợp X.
x,y là số mol RO và RCO3RCO3
Ta có : (R+16)x+(R+60)y=a(R+16)x+(R+60)y=a (*)
Từ (1) và (2) \Rightarrow (R+96)(x+y)=1,68a (**)
Từ (2) \Rightarrow y=0,01a (***)
Giải (*),(**) và (***) \Rightarrow x=0,004a : R=24
Vậy R là Mg
tại sao y=0,01a