Cho hai thanh Zn có khối lượng bằng nhau. Thanh 1 nhúng vào dung dịch có n mol AgNO3. Thanh 2 nhúng vào dung dịch có n mol Cu(NO3)2. Biết các muối tham gia phản ứng hết. So sánh hai thanh kim loại sau khi phản ứng kết thúc.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)

Đáp án C
Tổng khối lượng 2 thanh kim loại sau phản ứng vẫn là 2a gam
=> mthanh 1 tăng = mthanh 2 tăng
Đặt số mol kim loại phản ứng với AgNO3 và Cu(NO3)2 lần lượt là x, y
=> 108 . 2 x - M X . x = M X . y - 64 y ( 1 )
Nồng độ mol của muối kim loại X trong dung dịch Cu(NO3)2 gấp 10 lần trong dung dịch AgNO3.
⇒ y 1 , 5 = 10 . x 0 , 1 ⇒ y = 150 x thay vào (1) được:
108 . 2 x - M X . x = M X . 150 x - 64 . 150 x ⇒ M X = 65 => X là Zn.

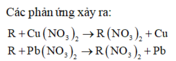
Khối lượng thanh 1 giảm do khối lượng mol của R lớn hơn Cu và khối lượng thanh 2 tăng do khối lượng mol của M nhỏ hơn Pb.
Gọi số mol R đã phản ứng ở 2 trường hợp là a.
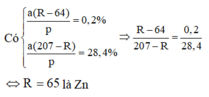
Đáp án C

Đáp án B
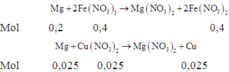
Nếu Cu(NO3)2 phản ứng hết như phản ứng trên thì
![]()
Do đó tiếp tục xảy ra phản ứng:
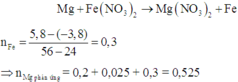
Vậy mMg phản ứng = 12,6 (gam)


Số mol: 0,16......0,16.............................0,16
Sau phản ứng với dung dịch CuSO4 khối lượng thanh kim loại là
![]()
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
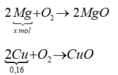
mO2 = (m + 12,8) – (m + 6,4) = 6,4 → nO2 = 0,2 mol
0,5 x + 0,08 = 0,2 → x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
0,24 . 24 + 0,16 . 64 = 16 gam
Đáp án C

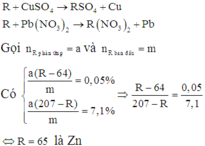


Để kim loại M đẩy được kim loại X ra khỏi dung dịch muối của nó với phản ứng:
xM (r) + nXx+ (dd) xMn+ (dd) + nX (r)
Phải có điều kiện :
+ M đứng trước X trong dãy thế điện cực chuẩn + Cả M và X đều không tác dụng được với nước ở điều kiện thường + Muối tham gia phản ứng và muối tạo thành phải là muối tan
- Khối lượng chất rắn tăng: ∆m↑ = mX tạo ra – mM tan - Khối lượng chất rắn giảm: ∆m↓ = mM tan – mX tạo ra - Khối lượng chất rắn tăng = khối lượng dung dịch giảm - Ngoại lệ:
+ Nếu M là kim loại kiềm, kiềm thổ (Ca, Sr, Ba) thì M sẽ khử H+ của H2O thành H2 và tạo thành dung dịch bazơ kiềm. Sau đó là phản ứng trao đổi giữa muối và bazơ kiềm + Ở trạng thái nóng chảy vẫn có phản ứng: 3Na + AlCl3 (khan) → 3NaCl + Al + Với nhiều anion có tính oxi hóa mạnh như NO3 – ; MnO 4 – , …thì kim loại M sẽ khử các anion trong môi trường axit (hoặc bazơ)
- Hỗn hợp các kim loại phản ứng với hỗn hợp dung dịch muối theo thứ tự ưu tiên: kim loại khử mạnh nhất tác dụng với cation oxi hóa mạnh nhất để tạo ra kim loại khử yếu nhất và cation oxi hóa yếu nhất - Thứ tự tăng dần giá trị thế khử chuẩn (Eo) của một số cặp oxi hóa – khử: Mg2+/Mg < Al3+/Al < Zn2+/Zn < Cr3+/Cr < Fe2+/Fe < Ni2+/Ni < Sn2+/Sn < Pb2+/Pb < 2H+/H2 < Cu2+/Cu < Fe3+/Fe2+ < Ag+/Ag < Hg2+/Hg < Au3+/Au