trộn 5,4 gam nhôm và 17,4 gam Fe3O4 rồi tiến hành phản ứng nhiệt nhôm. Giả sử chỉ xảy ra quá trình khử Fe3O4 thành Fe. Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng vào dd H2SO4 loãng thu được 5,376 lít khí H2(đktc). Tính hiệu suất của phản ứng nhiệt nhôm.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
nAl = 0,2 mol ; nFe3O4 = 0,075 mol ; nH2 = 0,24 mol
Phản ứng xảy ra không hoàn toàn:
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
x 0,5x (mol)
Hòa tan chất rắn (Fe, Al dư) vào H2SO4 ⇒H2
BT e ta có: 2.nFe + 3.nAl = 2.nH2
⇒ 9/8.x.2 + (0,2 – x).3 = 0,24.2 ⇒ x = 0,16 mol ⇒ Hphản ứng = 0,16/0,2 = 80%
BT e ⇒nH+phản ứng = 2.nFe + 3.nAl + 6.nAl2O3 + 8.nFe3O4 = 0,36 + 0,12 + 0,48 + 0,12 = 1,08 mol
⇒ nH2SO4phản ứng = 1,08/2 = 0,54mol

Đáp án D
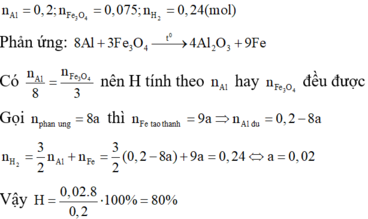
Chú ý: Trong một phương trình phản ứng, để nhẩm nhanh chất nào phản ứng hết trước khi biết cụ thể số mol từng chất trước phản ứng, ta lấy số mol ban đầu của mỗi chất chia hệ số của chất đó trong phương trình phản ứng, chất nào có thương thu được nhỏ nhất thì chất đó hết trước.
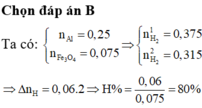


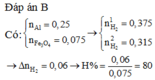
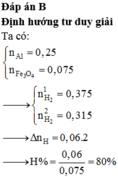
$n_{Al} = 0,2(mol) ; n_{Fe_3O_4} = 0,075(mol)$
$8Al + 3Fe_3O_4 \xrightarrow{t^o} 9Fe + 4Al_2O_3$
Vì $n_{Al} : 8 = n_{Fe_3O_4} : 3$ nên gọi hiệu suất là a
Suy ra: $n_{Al\ pư} = 0,2a(mol) ; n_{Al\ dư} = 0,2 - 0,2a(mol)$
$n_{Fe} = \dfrac{9}{8}n_{Al} = 0,225a(mol)$
Mà :
$n_{H_2} = 1,5n_{Al} + n_{Fe} = 1,5(0,2 - 0,2a) + 0,225a = \dfrac{5,376}{22,4}$
$\Rightarrow a = 0,8 = 80\%$