Đốt cháy hoàn toàn m gam FeS trong oxi dư thu được a gam khí SO2. Oxi hóa hoàn toàn a gam SO2 thu được b gam SO3. Hấp thụ hết b gam SO3 vào nước thu được 50 gam dd H2SO4 12,25% . Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 5. a) \(SO_2+\dfrac{1}{2}O_2-^{t^o,V_2O_5}\rightarrow SO_3\)
\(n_{SO_3}=n_{SO_2}=0,1\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,1\left(mol\right)\)
=> \(CM_{H_2SO_4}=\dfrac{0,1}{0,2}=0,5M\)
b) \(n_{Zn}=0,05\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Lập tỉ lệ : \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\)=> Sau phản ứng H2SO4 dư
=> \(m_{H_2SO_4\left(dư\right)}=\left(0,1-0,05\right).98=4,9\left(g\right)\)
Câu 5 . \(n_{Al_2O_3}=0,2\left(mol\right);n_{H_2SO_4}=0,8\left(mol\right)\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Lập tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,8}{3}\) => Sau phản ứng H2SO4 dư
\(m_{H_2SO_4}=\left(0,8-0,2.3\right).98=19,6\left(g\right)\)
b)\(n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,2\left(mol\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)

a) \(PTHH:2SO_2+O_2\xrightarrow[V_2O_5]{450^oC}2SO_3\)
\(n_{SO_2}=\dfrac{32}{64}=0,5\left(mol\right)\\ n_{O_2}=\dfrac{10}{32}=0,3125\left(mol\right)\)
Lập tỉ lệ: \(\dfrac{n_{SO_2}}{2}< \dfrac{n_{O_2}}{1}\left(\dfrac{0,5}{2}< 0,3125\right)\)
=> SO2 hết O2 dư
Theo pt: \(n_{O_2\left(pư\right)}=\dfrac{n_{SO_2}.2}{3}=\dfrac{0,5.1}{2}=0,25\left(mol\right)\)
\(n_{O_2\left(dư\right)}=0,3125-0,25=0,0625\left(mol\right)\\ m_{O_2}=0,0625.32=2\left(g\right)\)
c) Theo pt, ta có:\(n_{SO_3}=n_{SO_2}=0,5\left(mol\right)\)
\(m_{SO_3}=0,5.80=40\left(g\right)\)

Đáp án : B
. 2NaOH + SO3 -> Na2SO3 + H2O
=> mmuối = nNa2SO3.126 = nSO2.126 = 9,45g

Chọn đáp án C
Ta có:
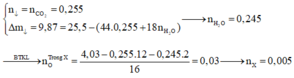
→ B T K L 8 , 06 + 0 , 01 . 3 . 40 = a + 0 , 01 . 92 → a = 8 , 34 g a m


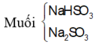

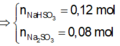
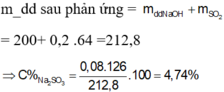

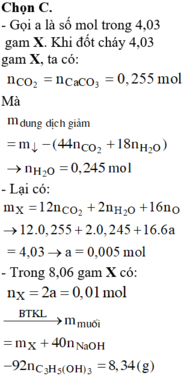
PTHH: \(4FeS+7O_2\rightarrow^{t^o}2Fe_2O_3+4SO_2\uparrow\)
\(2SO_2+O_2\rightarrow^{t^o}2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=\frac{50.12,25\%}{98}=0,0625mol\)
Theo phương trình \(n_{SO_3}=n_{SO_2}=n_{H_2SO_4}=0,0625mol\)
\(\rightarrow m_{SO_2}=0,0625.64=4g\)
\(\rightarrow m_{SO_3}=0,0625.80=5g\)
Theo phương trình \(n_{FeS}=n_{SO_2}=0,0625mol\)
\(\rightarrow m_{FeS}=0,0625.88=5,5g\)