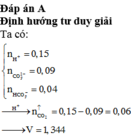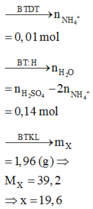Dẫn 0,672 lít hơi Brom vào dung dịch X chứa 0,03 mol Na2SO4; 0,09 mol Na2CO3; 0,03 mol Na2SO3 thu được dung dịch Y. Thêm BaCl2 dư vào Y thu được m gam kết tủa. Giá trị của m là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


QT cho e:
FexOy → xFe+3+ (3x-2y) e
0,03 0,03(3x-2y) mol
QT nhận e: nkhí X= 0,03 mol
-Nếu khí có 1 nguyên tử N: Gọi a là số oxi hóa của N có trong khí
N+5 + (5-a) e→ N+a
(5-a).0,03 0,03
Theo ĐL bảo toàn electron có:
0,03 (3x-2y)= 0,03 (5-a)
Nếu x=y=1 thì a= 4→ NO2
Nếu x=3, y=4 thì a= 4→ NO2
-Nếu khí có 2 nguyên tử N:
2N+5 + 2(5-a) e→ N2+a
(5-a).0,06 0,03
Theo ĐL bảo toàn electron có:
0,03(3x-2y)= (5-a).0,06 hay 3x-2y= 2(5-a)
Nếu x=y=1 thì a= 4,5 Loại
Nếu x=3, y=4thì a= 4,5 Loại
Vậy X là NO2
Đáp án A

Chọn D
C2H2 + AgNO3 -> Ag2C2↓
=> nkết tủa = nC2H2 =0,04 mol
,mbình tăng = mC2H2 + mC2H4 = 2,72g => nC2H4 = 0,06 mol
Đốt cháy : nCO2 = 2nC2H2 + 2nC2H4 = 0,2 mol
nOH = 0,15 mol < nCO2
=> phản ứng chỉ tạo HCO3 với số mol là 0,15 mol

Đáp án : A
0,02 mol Y chính là lượng khí không phản ứng với Br2
Bảo toàn khối lượng : mbình tăng = mchất phản ứng = mX – mY = 0,4g

\(n_{Br_2}=\dfrac{64}{160}=0,4\left(mol\right)\)
\(n_{hh}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,4<----0,4
\(\rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,4}{0,5}.100\%=80\%\\\%V_{CH_4}=100\%-80\%=20\%\end{matrix}\right.\)
\(C_{M\left(Br_2\right)}=\dfrac{0,4}{0,25}=1,6M\)

\(n_{Br_2}=\dfrac{64}{160}=0,4\left(mol\right)\\ n_{hh2khi}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ ChỉcóC_2H_4tácdụngvớiBr_2\\ PTHH:C_2H_4+Br_2\rightarrow C_2H_4Br_2\\ n_{C_2H_4}=n_{Br_2}=0,4\left(mol\right)\\ \Rightarrow n_{CH_4}=0,5-0,4=0,1\left(mol\right)\\ \%Vcũnglà\%n\\ \Rightarrow\%V_{CH_4}=\dfrac{0,1}{0,5}.100=20\%;\%V_{C_2H_4}=100-20=80\%\\ CM_{Br_2}=\dfrac{0,4}{0,25}=1,6M\)