Dẫn toàn bộ 0,2 mol H2 vào ống thuỷ tinh chứa 0,3 mol bột đồng (II) oxit CuO. Sau phản ứng, thu được kim loại đồng màu đỏ và khí H2. Chất nào dư, dư bao nhiêu gam? giải chi tiết giúp em với
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{HCl}=0,5a\left(mol\right)\)
PTHH:
2Al + 6HCl ---> 2AlCl3 + 3H2
Zn + 2HCl ---> ZnCl2 + H2
Mg + 2HCl ---> MgCl2 + H2
Fe + 2HCl ---> FeCl2 + H2
Theo các pthh: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}.0,5a=0,25a\left(mol\right)\)
\(n_{H_2\left(pư\right)}=0,25a.80\%=0,2a\left(mol\right)\)
\(m_{giảm}=m_O=40-36,8=3,2\left(g\right)\)
Bảo toàn O: \(n_{H_2\left(pư\right)}=n_O=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(\rightarrow0,2a=0,1\Leftrightarrow a=2\)

Gọi x là số mol CuO tham gia pư
ylà số mol CuO dư
CuO+H2----->Cu+H2O
Ta có hệ PT:
(x+y)80=28
64x+80y=24
⇒⇒ x=0,25;y=0,1
mH2O=0,25*18=4,5g
Đề bài yêu cầu là tìm \(H\) phản ứng chứ ko phải là \(m_{hơi.nước}\)

\(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
LTL : \(\dfrac{0,05}{1}>\dfrac{0,075}{2}\)
=> Fe dư
theo pthh : \(n_{Fe\left(p\text{ư}\right)}=\dfrac{1}{2}n_{HCl}=0,0375\left(mol\right)\\
\Rightarrow n_{Fe\left(d\right)\left(d\right)}=0,05-0,0375=0,0125\left(mol\right)\\
=>m_{Fe\left(d\right)}=0,0125.56=0,7\left(g\right)\)
theo pt trên => nH2 = 1/2nHCl = 0,0375 (mol)
\(pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,0375 0,0375
= > \(m_{Cu}=0,0375.64=2,4\left(g\right)\)

\(n_{Zn}=\dfrac{19.5}{65}=0.3\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{98}{98}=1\left(mol\right)\)
\(n_{CuO}=\dfrac{36}{80}=0.45\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.3.....................................0.3\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(0.3.......0.3.....0.3....0.3\)
\(m_{Cr}=m_{CuO\left(dư\right)}+m_{Cu}=\left(0.45-0.3\right)\cdot80+0.3\cdot64=31.2\left(g\right)\)
\(m_{H_2O}=0.3\cdot18=5.4\left(g\right)\)
Chúc em học tốt !!
Zn+H2SO4→ZnSO4+H2 bạn biến đổi nó ra phương trình này kiểu gì vậy?

Phải dùng 4,2 g Fe
Cần 6g sắt (III) oxit tác dụng với H2 dư

Đáp án C
Bảo toàn e : số e mà N+2(NO) nhận chính bằng số e trao đổi của O(oxit) trong phản ứng với hỗn hợp khí ( vì thực chất Fe2O3 và CuO không phản ứng oxi hóa tạo NO )
Do H2 và CO đều phản ứng với O(oxit) tỉ lệ mol 1 : 1 => nkhí = 0,5 mol
Và nO(oxit) = 0,4.3 + 0,2 = 1,4 mol => nO pứ = 0,5 mol
Bảo toàn e : 2nO pứ = 3nNO
=> VNO = 7,467 lit

Đáp án D
Vì hỗn hợp rắn sau phản ứng nhiệt phân có phản ứng với H2 nên trong hỗn hợp đó có chứa oxit của kim loại có khả năng phản ứng với H2.
Có thể coi quá trình khử diễn ra đơn giản như sau:
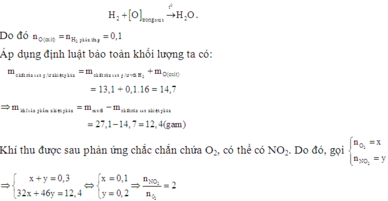

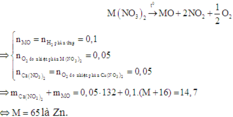
Vậy hai muối cần tìm là Ca(NO3)2 và Zn(NO3)2.
Nhận xét: Khi đến bước xác định được hỗn hợp có Ca(NO3)2 thì quan sát 4 đáp án, các bạn có thể kết luận được ngay đáp án đúng là D.
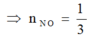
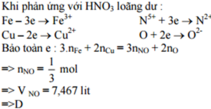
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(1............1\)
\(0.3.......0.2\)
\(LTL:\dfrac{0.3}{1}>\dfrac{0.2}{1}\Rightarrow CuOdư\)
\(m_{CuO\left(dư\right)}=\left(0.3-0.2\right)\cdot80=8\left(g\right)\)
Bạn ở trên làm kết quả đúng nhưng có lẽ không chi tiết lắm.
Xét tỉ lệ \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\) . Do đó sau phản ứng CuO còn dư
$\Rightarrow n_{CuO/pu}=n_{H_2}=0,2(mol)$
Rồi tiếp đoạn kia nhé