Cho 1,56g Kali vào 200g dung dịch CuSO4 8% thu được dung dịch A, khí B và kết tủa C.
a) Tính thể tích khí B (đktc)
b) Tính khối lượng chất rắn thu được khi nung C đến khối lượng không đổi.
c) Tính C% các chất có trong A?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CuSO_4}=\dfrac{200.16}{160.100}=0,2mol\)
\(n_{NaOH}=\dfrac{200.10}{40.100}=0,5mol\)
CuSO4+2NaOH\(\rightarrow\)Cu(OH)2\(\downarrow\)+Na2SO4
-Ta có tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\rightarrow\)CuSO4 hết, NaOH dư.
Cu(OH)2\(\overset{t^0}{\rightarrow}\)CuO+H2O
\(n_{CuO}=n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,2mol\)
a=\(m_{CuO}=0,2.80=16gam\)
\(m_{Cu\left(OH\right)_2}=0,2.98=19,6gam\)
\(n_{NaOH\left(pu\right)}=2n_{CuSO_4}=0,4mol\rightarrow n_{NaOH\left(dư\right)}=0,5-0,4=0,1mol\)
\(m_{NaOH\left(dư\right)}=0,1.40=4gam\)
\(n_{Na_2SO_4}=n_{CuSO_4}=0,2mol\rightarrow m_{Na_2SO_4}=0,2.136=27,2gam\)
\(m_{dd}=200+200-19,6=380,4gam\)
C%NaOH=\(\dfrac{4.100}{380,4}\approx1,05\%\)
C%Na2SO4=\(\dfrac{27,2.100}{380,4}\approx7,15\%\)

mCuSO4= 12,8(g) ->nCuSO4=0,2(mol)
nNa=0,04(mol)
pthh: Na + H2O -> NaOH + 1/2 H2
-> nNaOH= 0,04(mol); nH2=0,02(mol)
=> V(A,đktc)=V(H2,đktc)=0,02.22,4=0,448(l)
2 NaOH + CuSO4 -> Cu(OH)2 + Na2SO4
Ta có: 0,04/2 < 0,2/1
=> CuSO4 dư, NaOH hết, tính theo nNaOH
=> nCu(OH)2=nCuSO4(p.ứ)=nNa2SO4=nNaOH/2=0,02(mol)
=> m(B)=mCu(OH)2=0,02.98=1,96(g)
b) mddC=mddCuSO4 + mNaOH - mCu(OH)2= 400+ 0,04.40- 1,96= 399,64(g)
mCuSO4(dư)= 0,18 x 160=28,8(g)
mNa2SO4=0,02.142= 2,84(g)
=> C%ddCuSO4(dư)= (28,8/399,64).100=7,206%
C%ddNa2SO4=(2,84/399,64).100=0,711%

Tính toán theo PTHH :
Mg + CuSO4 → Cu + MgSO4
Mg + FeSO4 → Fe + MgSO4
Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2
Ba(OH)2 + FeSO4 → BaSO4 + Fe(OH)2
Mg(OH)2 → MgO + H2O
2 Fe(OH)2 + ½ O2 → Fe2O3 + 2 H2O
Giả sư dung dịch muối phản ứng hết
=> n Fe = n FeSO4 = 0,2 . 1= 0,2 mol => m Fe = 0,2 . 56 = 11,2 g
=> n Cu =n CuSO4 = 0,2 . 0,5 = 0,1 mol => m Cu = 0,1 . 64 = 6,4 g
=> m chất rắn = 11,2 + 6,4 = 17,6 g > 12 g > 6,4
=> kim loại Fe dư sau phản ứng Vì CuSO4 phản ứng trước sau đó mới đến FeSO4 phản ứng
CuSO4 đã hết và phản ứng với 1 phần FeSO4
12 g = m Cu + m Fe phản ứng = 6,4 g + m Fe phản ứng
=> m Fe = 5,6 g => n Fe = 0,1 mol => n FeSO4 dư = 0,2 – 0,1 = 0,1 mol
Theo PTHH : n Mg = 0,1 + 0,1 = 0,2 mol ( bắng số mol CuSO4 và FeSO4 phản ứng )
Theo PTHH : n Mg = n MgSO4 = n Mg(OH)2 = n MgO = 0,2 mol
n FeSO4 dư = n Fe(OH)2 = n Fe2O3 . 2 = 0,1 mol
=> n Fe2O3 = 0,1 mol
=> m chất rắn = m Fe2O3 + m MgO = 0,1 . 160 + 0,2 . 40 = 24 g

Đáp án A
Các phản ứng có thể xảy ra:
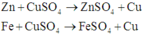
Trong 3 kim loại Zn, Fe và Cu thì Fe có khối lượng mol nhỏ nhất
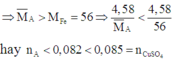
Do đó B chứa Cu2+ dư
Khi đó C chứa Cu trong A và Cu sinh ra sau phản ứng. Nên D chứa CuO.
B chứa Zn2+, Fe2+ và Cu2+ dư. Khi cho B tác dụng với dung dịch NaOH dư thì kết tủa thu được chứa Fe(OH)2 và Cu(OH)2 .
Do đó E chứa Fe2O3 và CuO.

a) mNaOH= 200.20%= 40(g)
=>nNaOH=1(mol)
PTHH: 2 NaOH + CuCl2 -> 2 NaCl + Cu(OH)2
Dung dịch sau khi lọc kết tủa có NaCl.
nNaCl=nNaOH= 1(mol)
nCuCl2=nCu(OH)2=nNaOH/2=1/2=0,5(mol)
mNaCl=1.58,5=58,5(g)
mCuCl2=0,5.135=67,5(g)
=> mddCuCl2=(67,5.100)/10=675(g)
mCu(OH)2=0,5.98=49(g)
=>mddNaCl=mddNaOH+ mddCuCl2 - mCu(OH)2= 200+675 - 98=777(g)
=> \(C\%ddNaCl=\dfrac{58,5}{777}.100\approx7,529\%\)
b) PTHH: Cu(OH)2 -to-> CuO + H2O
0,5__________________0,5(mol)
m(rắn)=mCuO=0,5.80=4(g)
Ta có: \(n_K=\dfrac{1,56}{39}=0,04\left(mol\right)\)
\(m_{CuSO_4}=200.8\%=16\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\)
PT: \(2K+2H_2O\rightarrow2KOH+H_2\)
___0,04___________0,04___0,02 (mol)
\(2KOH+CuSO_4\rightarrow K_2SO_4+Cu\left(OH\right)_{2\downarrow}\)
Xét tỉ lệ: \(\dfrac{0,04}{2}< \dfrac{0,1}{1}\), ta được CuSO4 dư.
Theo PT: \(n_{Cu\left(OH\right)_2}=n_{CuSO_4\left(pư\right)}=n_{K_2SO_4}=\dfrac{1}{2}n_{KOH}=0,02\left(mol\right)\)
⇒ nCuSO4 (dư) = 0,08 (mol)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
___0,02____0,02 (mol)
a, Ta có: VB = 0,02.22,4 = 0,448 (l)
b, mCuO = 0,02.80 = 1,6 (g)
c, Ta có: m dd sau pư = 1,56 + 200 - 0,02.2 - 0,02.98 = 199,56 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{K_2SO_4}=\dfrac{0,02.174}{199,56}.100\%\approx1,74\%\\C\%_{CuSO_4\left(dư\right)}=\dfrac{0,08.160}{199,56}.100\%\approx6,41\%\end{matrix}\right.\)
Bạn tham khảo nhé!
\(n_K=\dfrac{1,56}{39}=0,04\left(mol\right)\)
\(n_{CuSO4}=\dfrac{200.8}{100.160}=0,1\left(mol\right)\)
\(2K+2H2O\rightarrow2KOH+H2\)
0,04--------------->0,04------------->0,02(mol)
\(2KOH+CuSO4\rightarrow Cu\left(OH\right)2+K2SO4\)
0,04-------->0,02----->0,02------->0,02(mol)
=> dd A gồm CuSO4 dư và K2SO4
=> Khí B là H2
=>Kết tủa C là Cu(OH)2
a) \(V_{H2}=0,02.22,4=0,448\left(l\right)\)
b)\(Cu\left(OH\right)2\rightarrow CuO+H2O\)
0,02---------------->0,02(mol)
\(m_{CuO}=0,02.80=1,6\left(g\right)\)
c) \(m_{KOH}=0,04.56=2,24\left(g\right)\)
\(m_{Cu\left(OH\right)2}=0,02.98=1,96\left(g\right)\)
\(\Rightarrow\)\(m_{dd}=200+2,24-1,96=200,28\left(g\right)\)
\(C\%_{K2SO4}=\dfrac{0,02.174}{200,28}.100\%=1,74\%\)
\(n_{CuSO4}dư=0,1-0,02=0,08\left(mol\right)\)
\(C\%_{CuSO4}=\dfrac{0,08.160}{200,28}.100\%=6,39\%\)
Chúc bạn học tốt^^