1. Cho x gam một muối halogenua của một kim loại kiềm tác dụng với 200ml dd H2SO4 đặc, nóng vừa đủ. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp sản phẩm A trong đó có một khí B (mùi trứng thối). Cho khí B tác dụng với dd Pb(NO3)2 (dư) thu được 47,8 gam kết tủa màu đen. Phần sản phẩm còn lại, làm khô thu được 342,4 gam chất rắn T. Nung T đến khối lượng không đổi thu được 139,2 gam muối duy nhất.
a. Tính nồng độ mol/lit của dd H2SO4 ban đầu.
b. Xác định công thức phân tử của muối halogenua và tính x.
2. Cho M là kim loại tạo ra hai muối MClx, MCly và tạo ra 2 oxit MO0,5x, M2Oy có thành phần về khối lượng của Clo trong 2 muối có tỉ lệ 1 : 1,173 và của oxi trong 2 oxit có tỉ lệ 1 : 1,352.
a. Xác định tên kim loại M và công thức hóa học các muối, các oxit của kim loại M.
b. Viết các phương trình phản ứng khi cho M tác dụng lần lượt với MCly; H2SO4 đặc, nóng.


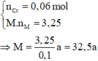




1)
a) Khí B mùi trứng thối => H2S
$Pb(NO_3)_2 + H_2S \to PbS + 2HNO_3$
n H2S = n PbS = 47,8/239 = 0,2(mol)
Gọi CTHH của muối halogen là RX
8RX + 5H2SO4 đặc,nóng → 4R2SO4 + H2S + 4X2 + 4H2O
n H2SO4 = 5n H2S = 0,2.5 = 1(mol)
CM H2SO4 = 1/0,2 = 5M
T gồm R2SO4,X2
Khi nung thì chỉ còn lại R2SO4
=> m X2 = 342,4 - 139,2 = 203,2(gam)
n X2 = 4n H2S = 0,8(mol)
=> M X2 = 2X = 203,2/0,8 = 254
=> X = 127(Iot)
Theo PTHH :
n R2SO4 = n X2 = 0,8(mol)
=> M R2SO4 = 2R + 96 = 139,2/0,8 = 174
=> R = 39(Kali)
Vậy Muối cần tìm là $KI$
n KI = 2n R2SO4 = 1,6(mol)
=> x = 1,6.166 = 265,6 gam
Bài 2:
a)