Hỗn hợp X có MgO và CaO; hỗn hợp Y có MgO và Al2O3. Lượng X bằng lượng Y bằng 9,6g. Số gam MgO trong X bằng 1,12 lần số gam MgO trong Y. Cho X và Y đều tác dụng với 100ml dd HCl 19,87% (D=1,047g/ml) thì được dd X' và Y'. Khi cho X' tác dụng hết với Na2CO3 thì có 1,904 dm3 khí CO2 thoát ra ở đktc.
a. Tìm % lượng X và C% của dd X'
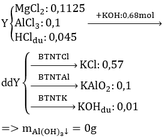
b. Hỏi Y có tan hết không? Nếu cho 340ml KOH 2M vào thì tách ra được bao nhiêu gam kết tủa?


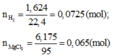
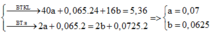
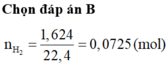
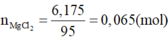
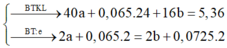
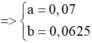
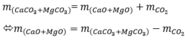
mình nghĩ đề bài phải là 9.5 g ở chỗ mX=mY
Đặt x,y lần lượt là số mol của MgO và CaO trong hỗn hợp X
vậy hỗn hợp Y có nMgO =x/1,125 mol
=>nHCl =0,57 mol
pu : MgO +2HCl------>MgCl2+H2O
........x........2x...............x
CaO+2HCl------>CaCl2+H2O
y...........2y............y
Vì X'+Na2CO3-------->CO2 nên trong X' có HCl
Na2CO3+2HCl ----->2NaCl+H2O+CO2
0,17........0,085.............................0,17
ta có hệ pt:{2x+2y=0,57−0,17=0,0440x+56y=9,6{2x+2y=0,57−0,17=0,0440x+56y=9,6⇔{x=0,1y=0,1⇔{x=0,1y=0,1
thành phần % của hỗn hợp X là
%m MgO =(0,1*40)*100/9,6=41,67%
%mCaO =58,33%
mX'=9,6+(100*1,047)=114,3g
nồng độ % của các chất trong X '
C% CaCl2 =(0,1*111)*100/114,3=9,71%
C%MgCl2=(0,1*95)*100/114,3=8,31%
C%HCl=(0,17*36,5)*100/114,3=5,43%
b)nMgO (trong Y) =0,089mol ,nAl2O3=(9,6=0,089*40)/102 =0,059 mol
vì nHCl=0,57>2.0,089+6.0,059 =0,532 mol nên hỗn hợp Y bj hòa tan hết
số mol KOH-0,34*2-0,68 mol
trong Y có 0,038 mol HCl
KOH +HCl ----->KCl+Mg(OH)2
0,038...0,038
2KOH+MgCl2 ------>KCl +Mg(OH)2
0,178..0,089......................0,089
3KOH + AlCl3------>3KCl +Al(OH)3
0,354....0,118.........................0,118
lượng KOH dư =0,68 -(0,038+0,178+0,354)=0,11 mol
......Al(OH)3+KOH-------->KAlO2+ 2H2O
BĐ 0,118.....0,11
pu 0,11........0,11
spu 0,08.........0
vậy khôi lượng kết tủa thu đc là m=0,089*58 +0,008*78 =11,362g