Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

=> nCuSO4nCuSO4 = 2,51602,5160 = 0,015625 ( mol)
mH2OmH2O = 50 - 2,5 = 47,5(g)
- Học sinh A: khi làm bay hơi phân nửa lượng nước thì:
mH2OmH2O bị loại = 47,5247,52 = 23,75(g)
mdd sau = 50 - 23,75 = 26,25(g)
CC = 2,526,252,526,25 . 100% = 9,52% ( sai)
- Học sinh B: khi cho thêm 2,78g CuSO4CuSO4 khan vào dung dịch thì :
mCuSO4mCuSO4 = 2,5 + 2,78 = 5,28 (g)
mdd = 50 + 2,78 = 52,78(g)
CC = 5,2852,785,2852,78 . 100% = 10% ( đúng)
- Học sinh C: khi thêm 4,63g tinh thể CuSO4.5H2OCuSO4.5H2O vào dung dịch thì :
mCuSO4mCuSO4 thêm vào = 160.4,63250160.4,63250 = 2,9632(g)
mCuSO4mCuSO4 sau = 2,5 + 2,9632 = 5,4632(g)
mdd CuSO4 = 50 + 4,63 = 54,63(g)
CC = 5,463254,635,463254,63 . 100% = 10% ( đúng)
- Học sinh D: khi thêm 50g dung dịch CuSO4 15% vào dung dịch thì:
mCuSO4mCuSO4 thêm vào = 50.1510050.15100 = 7,5(g)
mCuSO4mCuSO4 sau = 2,5 + 7,5 = 10(g)
mdd CuSO4 = 50 + 50 = 100 (g)
CC = 1010010100 . 100% = 10% ( đúng)
=> các học sinh B, C và D làm đúng.

mCuSO4bđ = 60g và mH2O = 540g
Gọi x là số mol CuSO4.5H2O => mCuSO4.5H2O=250x gam
và mCuSO4 tham gia ktinh = 160x gam
Dung dịch còn lại có: mdd = 600-400-250x = (200 - 250x) gam
và mCuSO4 còn lại = (60 - 160x) gam
Ta có: (60 - 160x):(200 - 250x) = 0,2 => x = 2/11 =>mCuSO4.5H2O = 45,45 gam

`a)`
`m_{CuSO_4}=200.15\%=30(g)`
`m_{H_2O}=200-30=170(g)`
Cách pha: cho `30g\ CuSO_4` rắn vào cốc, rót từ từ `170g` nước cất vào cốc rồi khuấy đều.
`b)`
`m_{CuSO_4\ bd}=a.15\%=0,15a(g)`
`->m_{H_2O\ bd}=a-0,15a=0,85a(g)`
`->m_{H_2O\ them}=0,85a(g)`
`->C\%_E={0,15a}/{a+0,85a}.100\%\approx 8,11\%`

\(m_{CuSO_4\left(8\%\right)}=500\cdot8\%=40\left(g\right)\)
\(n_{CuSO_4\cdot5H_2O}=a\left(mol\right)\)
\(\Rightarrow n_{CuSO_4}=a\left(mol\right)\)
\(m_{CuSO_4\left(15\%\right)}=160a+40\left(g\right)\)
\(m_{dd_{CuSO_4\left(15\%\right)}}=250a+500\left(g\right)\)
\(C\%_{CuSO_4}=\dfrac{160a+40}{250a+500}\cdot100\%=15\%\)
\(\Leftrightarrow a=\dfrac{2}{7}\)
\(m_{CuSO_4\cdot5H_2O}=\dfrac{2}{7}\cdot250=71.42\left(g\right)\)

Câu 4:
mdd = 0.35*106+0.35*10*18+234.9=335g
=> C% dd Na2CO3 = 0.35*106*100/335 = 11.07%
Vdd = 0.35*10*18+234.9=297.9ml (coi như Na2CO3 có thể tích ko đáng kể)
=> CmddNa2CO3 = 0.35/0.2979=1.17M
=> D = m/V = 335/297.9 = 1.12 g/ml
Câu 3:
:trong 560g d^2CuSO4 16%
\(mct=\dfrac{16.560}{100}=89,6g\)
Đặt mCuSO4.5H2O = x(g)
1mol(hay 250g) CuSO4.5H2O chứa 160g CuSO4
Vậy x(g) // chứa = (g)
mdd CuSO4 8% có trong dd CuSO4 16% là ( 560 - x ). g
mct CuSO4( có trong dd CuSO4 8%) là = \(\dfrac{8\left(560-x\right)}{100}=\dfrac{2\left(560-x\right)}{25}\left(g\right)\)
Ta có phương trình: \(\dfrac{560-x)2}{25}+\dfrac{16x}{25}=89,6\)
Giải phương trình được: x = 80.
Vậy cần lấy 80g tinh thể CuSO4.5H2O và 480g dd CuSO4 8% để pha chế thành 560g dd CuSO4 16%.
Ta có phương trình:

=> =
=  = 0,015625 ( mol)
= 0,015625 ( mol)
 = 50 - 2,5 = 47,5(g)
= 50 - 2,5 = 47,5(g)
 bị loại =
bị loại =  = 23,75(g)
= 23,75(g)
 =
=  . 100% = 9,52% ( sai)
. 100% = 9,52% ( sai)
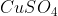 khan vào dung dịch thì :
khan vào dung dịch thì :
 = 2,5 + 2,78 = 5,28 (g)
= 2,5 + 2,78 = 5,28 (g)
 =
=  . 100% = 10% ( đúng)
. 100% = 10% ( đúng)
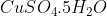 vào dung dịch thì :
vào dung dịch thì :
 thêm vào =
thêm vào =  = 2,9632(g)
= 2,9632(g)
 sau = 2,5 + 2,9632 = 5,4632(g)
sau = 2,5 + 2,9632 = 5,4632(g)
 =
=  . 100% = 10% ( đúng)
. 100% = 10% ( đúng)
 thêm vào =
thêm vào =  = 7,5(g)
= 7,5(g)
 sau = 2,5 + 7,5 = 10(g)
sau = 2,5 + 7,5 = 10(g)
 =
=  . 100% = 10% ( đúng)
. 100% = 10% ( đúng)
- Học sinh A: khi làm bay hơi phân nửa lượng nước thì:
mdd sau = 50 - 23,75 = 26,25(g)
- Học sinh B: khi cho thêm 2,78g
mdd = 50 + 2,78 = 52,78(g)
- Học sinh C: khi thêm 4,63g tinh thể
mdd CuSO4 = 50 + 4,63 = 54,63(g)
- Học sinh D: khi thêm 50g dung dịch CuSO4 15% vào dung dịch thì:
mdd CuSO4 = 50 + 50 = 100 (g)
=> các học sinh B, C và D làm đúng.
118045.html cau hoi tuong tu :V