Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

đề bảo "pư đạt trạng thái cân bằng" chứ không phải "phản ứng hoàn toàn" nên cần thêm dữ kiện để tính câu b) á :v

a) nCH3COOH= 0,4(mol)
PTHH: CH3COOH + NaOH -> CH3COONa + H2O
0,4____________0,4(mol)
=> mNaOH=0,4. 40=16(g)
b) nCH3COOH= 1(mol)
nC2H5OH= 100/46= 50/23(mol)
Vì : 1/1< 50/23 :1
=> C2H5OH dư, CH3COOH hết, tính theo nCH3COOH.
PTHH: CH3COOH + C2H5OH \(⇌\) CH3COOC2H5 + H2O (đk: H+ , nhiệt độ)
Ta có: nCH3COOC2H5(thực tế)= 0,625(mol)
Mà theo LT: nCH3COOC2H5(LT)= nCH3COOH=1(mol)
=>H= (0,625/1).100=62,5%

Đáp án: C
PTHH: C H 3 C O O H + C 2 H 5 O H ⇄ H 2 S O 4 , t 0 C H 3 - C O O C 2 H 5 + H 2 O
Theo PTHH, vì lượng C 2 H 5 O H dư nên lượng C H 3 C O O C 2 H 5 theo lí thuyết phải tính theo lượng C H 3 C O O H .
Theo lí thuyết số mol C H 3 C O O H phản ứng là 1 mol
=> khối lượng C H 3 C O O C 2 H 5 thu được theo lí thuyết = 1.88 = 88 gam
Thực tế chỉ thu được 55 gam
=> hiệu suất phản ứng H = 55 88 . 100 % = 62 , 5 %

\(n_{CH_3COOH}=\dfrac{120}{60}=2\left(mol\right)\)
\(n_{C_2H_5OH}=\dfrac{46}{46}=1\left(mol\right)\)
\(CH_3COOH+C_2H_5OH⇌CH_3COOC_2H_5+H_2O\left(ĐK:H_2SO_{4\left(đ\right)},t^0\right)\)
\(Bđ:\) \(2.........................1\)
\(Pư:1.......................1.....................1\)
\(KT:1.....................0...................1\)
\(m_{CH_3COOC_2H_5}=1\cdot88=88\left(g\right)\)
\(H\%=\dfrac{52.8}{88}\cdot100\%=60\%\)

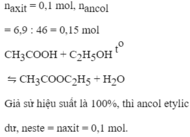
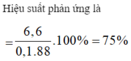

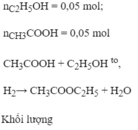
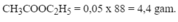
nCH3COOH = 60/60 = 1 mol;
nC2H5OH = 100/46 ≈ 2,17 mol.
CH3COOH + C2H5OH CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Theo phương trình phản ứng, vì lượng C2H5OH dư nên lượng CH3COOC2H5 theo lí thuyết phải tính theo lượng CH3COOH. Theo phản ứng số mol của CH3COOH là 1 mol.
Khối lượng CH3COOH theo lí thuyết = 1.88 = 88 gam.
Thực tế chỉ thu được 55 gam.
Vậy hiệu suất của phản ứng là : H% = 55/88 *100% = 62,5%
Chúc bạn học tốt <3
88g lấy ở đâu thế ạ?