Cho 16 gam CUO vào 200ml dung dịch HNO3 được dung dịch x . Cho x tác dụng với dung dịch NaOH 1M đến khi phản ứng hoàn toàn thấy hết 500ml. tính nồng độ mol của dung dịch HNO3?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa đỏ: HCl, H2SO4 (1)
+ Quỳ không đổi màu: NaCl
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: H2SO4
PT: \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
+ Không hiện tượng: HCl
- Dán nhãn.

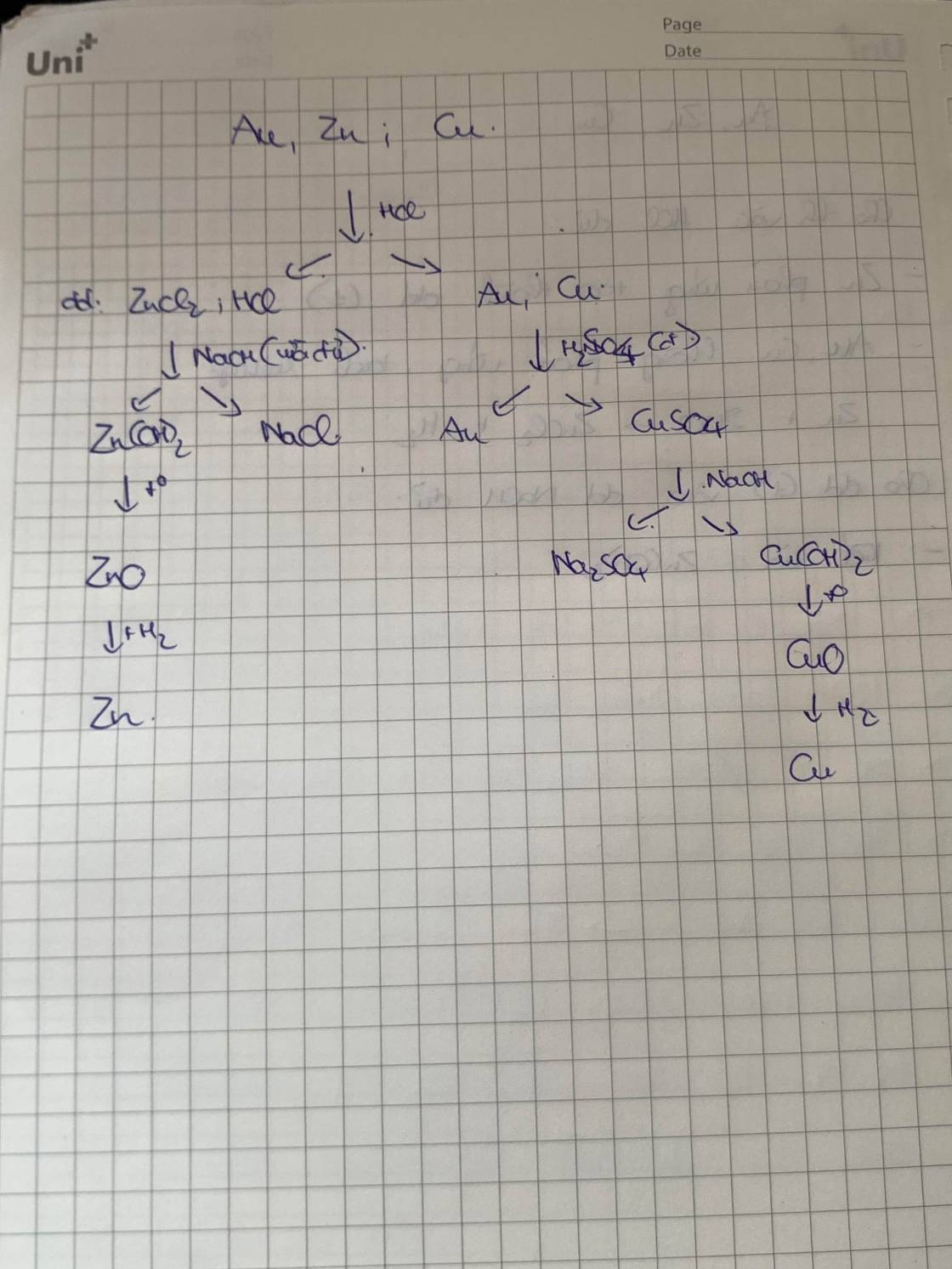
Bước 1: Nung chảy hỗn hợp của cả 3 kim loại.
Bước 2: Khi hỗn hợp đã nóng chảy, sẽ thấy các lớp kim loại tách ra dựa trên mật độ của chúng. Vàng, có mật độ cao hơn, sẽ nằm ở đáy. Đồng sẽ nằm ở giữa và kẽm sẽ ở trên cùng.
Bước 3: Dùng một cái muôi hoặc ống hút, là đã có thể lấy từng lớp kim loại ra khỏi hỗn hợp.
Tick cho e với

| Thành phần | Công thức hóa học | Phân tử khối |
| Na và Cl | NaCl | 58,5 |
| Mg và CO3 | MgCO3 | 84 |
| K và OH | KOH | 56 |

\(CaCO_3+2HCl\underrightarrow{ }CaCl_2+CO_2+H_2O\)
\(nCaCO_3=\dfrac{15}{100}=0,15\left(mol\right)\)
\(nHCl=\dfrac{20.36,5}{100.36,5}=0,2\left(mol\right)\)
Vậy \(CaCO_3\) dư
a. Rắn B là: CaCO3 dư
\(nCaCO_3\) phản ứng là: 0,2:2 = 0,1 (mol)
\(nCaCO_3\) dư : 0,05 (mol)
Khối lượng rắn CaCO3 là : 0,05.100 = 5 (g)
b. Theo PTHH em dễ dàng tính được nồng độ dd B (CaCl2):
Khối lượng CaCl2: 0,1.111 = 11,1(g)
Khối lượng khí CO2: 0,1.44 = 4,4 (g)
Khối lượng dd sau phản ứng:
15+20 - 5 - 4,4 = 25,6 (g)
Nồng độ % dung dịch CaCl2: \(\dfrac{11,1}{25,6}.100\%=43,36\%\)
c. Thể tích CO2 ở đtc:
0,1.24,79 = 2,479 (l)
\(n_{CaCO_3}=\dfrac{15}{100}=0,15mol\\ n_{HCl}=\dfrac{20.36,5}{100.36,5}=0,2mol\\ CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\\ \rightarrow\dfrac{0,15}{1}>\dfrac{0,2}{2}=>CaCO_3.dư\\ n_{CaCO_3pư}=n_{CaCl_2}=n_{CO_2}=\dfrac{0,2}{2}=0,1mol\\ a.m_B=m_{CaCO_3.dư}=\left(0,15-0.1\right).100=5g\\ b.m_{dd}=0,1.100+20-0,1.44=25,6g\\ C_{\%CaCl_2}=\dfrac{0,1.111}{25,6}\cdot100=43.36\%\\ c.ddC?\)

Ta có: nMg = 0,1 (mol)
\(Mg+2Ag^+\rightarrow Mg^{2+}+2Ag\)
0,01____0,02___________0,02 (mol)
\(Mg+Cu^{2+}\rightarrow Mg^{2+}+Cu\)
0,09____0,09___________0,09 (mol)
⇒ m chất rắn = mAg + mCu = 0,02.108 + 0,09.64 = 7,92 (g)

Ta có: nCO2 = 0,075 (mol)
nNaOH = 0,1 (mol)
nBa(OH)2 = 0,05 (mol)
Pư xảy ra theo thứ tự:
Ba(OH)2 + CO2 → BaCO3 + H2O
0,05_______0,05____0,05 (mol)
2NaOH + CO2 → Na2CO3 + H2O
0,05______0,025 (mol)
⇒ m↓ = mBaCO3 = 0,05.197 = 9,85 (g)
\(CuO+2HNO_3\rightarrow Cu\left(NO_3\right)_2+H_2O\)
0,2 0,4 0,2
Giả sử \(HNO_3\) không dư, phản ứng trên vừa đủ.
Dung dịch X chỉ chứa duy nhất \(Cu\left(NO_3\right)_2\)
\(Cu\left(NO_3\right)_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaNO_3\)
0,25<------0,5
\(n_{NaOH}=0,5.1=0,5\left(mol\right)\)
Từ phương trình hóa học thấy 0,25>0,2 => Giả sử sai, \(HNO_3\) dư sau phản ứng.
Đặt số mol \(HNO_3\) dư là x
\(HNO_3+NaOH\rightarrow NaNO_3+H_2O\)
x------->x
\(Cu\left(NO_3\right)_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaNO_3\)
0,2---------->0,4
Có: \(x+0,4=n_{NaOH}=0,5\Rightarrow x=0,1\)
=> Tổng mol \(HNO_3=0,4+x=0,4+0,1=0,5\left(mol\right)\)
\(\Rightarrow CM_{HNO_3}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)