Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lưu ý: Ở điểm dừng, nếu không thấy nút nộp bài, bạn hãy kéo thanh trượt xuống dưới.
Bạn phải xem đến hết Video thì mới được lưu thời gian xem.
Để đảm bảo tốc độ truyền video, OLM lưu trữ video trên youtube. Do vậy phụ huynh tạm thời không chặn youtube để con có thể xem được bài giảng.
Nội dung này là Video có điểm dừng: Xem video kết hợp với trả lời câu hỏi.
Nếu câu hỏi nào bị trả lời sai, bạn sẽ phải trả lời lại dạng bài đó đến khi nào đúng mới qua được điểm dừng.
Bạn không được phép tua video qua một điểm dừng chưa hoàn thành.
Dữ liệu luyện tập chỉ được lưu khi bạn qua mỗi điểm dừng.
1. Tốc độ phản ứng đặc trưng cho sự nhanh chậm của một phản ứng hoá học.
2. Tốc độ trung bình của phản ứng được tính bằng sự thay đổi lượng chất trong một đơn vị thời gian.
Xét phản ứng: H2 + Cl2 ⟶ 2HCl
Nghiên cứu sự thay đổi nồng độ của một chất trong phản ứng thu được đồ thị sau:
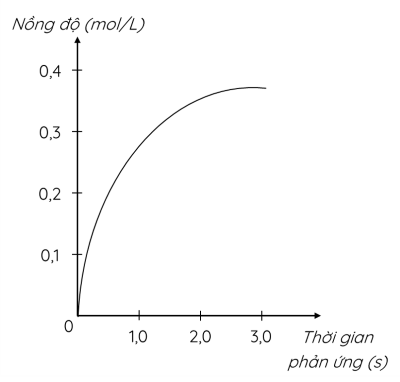
Đồ thị mô tả sự thay đổi nồng độ của chất nào?
Xét phản ứng: H2 + Cl2 ⟶ 2HCl
Nghiên cứu sự thay đổi nồng độ của một chất trong phản ứng thu được đồ thị sau:

Đơn vị của tốc độ phản ứng trong trường hợp này là
Cho phản ứng phân hủy N2O5:
2N2O5(g) ⟶ 4NO2(g) + O2(g)
Nồng độ mỗi chất tại t = 0 s và t = 100 s được cho ở bảng sau:
Nồng độ (M) | N2O5 | NO2 | O2 |
t = 0 s | 0,0200 | 0 | 0 |
t = 100 s | 0,0169 | 0,0062 | 0,0016 |
Tốc độ trung bình của phản ứng tính theo N2O5 là .10-5 (M/s).
Tốc độ trung bình của phản ứng tính theo NO2 là .10-5 (M/s).
Cho phản ứng hóa học sau:
H2(g) + I2(g) ⟶ 2HI(g)
Biểu thức tính tốc độ tức thời của phản ứng là
Tại thời điểm nồng độ H2 và I2 bằng 1 M, tốc độ phản ứng bằng bao nhiêu?
Văn bản dưới đây là được tạo ra tự động từ nhận diện giọng nói trong video nên có thể có lỗi
- [âm nhạc]
- Xin chào các em Chào mừng các em đã quay
- trở lại với khóa học Hóa học lớp 10 tại
- olm.vn các em thân mến trong cuộc sống
- hàng ngày của chúng ta có rất nhiều phản
- ứng hóa học xảy ra trong đó có những
- phản ứng xảy ra nhanh như phản ứng đốt
- than cũng có những phản ứng xảy ra chậm
- như phản ứng
- rét dựa vào đâu để người ta đánh giá mức
- độ nhanh chậm của phản ứng hóa
- học câu trả lời sẽ có sau khi chúng ta
- HC xong phần 1 của bài HC tốc độ phản
- ứng hóa
- học bài học này gồm ba nội dung chính
- bao gồm tốc độ phản ứng hóa học Định
- luậtc dụng khối lng và yếu tố ảnh hưởng
- đến tốc độ phản
- ứng nội dung đầu ti tốc độ phản ứng hóa
- học
- khi một phản ứng hóa học xảy ra theo
- thời gian lượng chất phản ứng dạm dần
- lượng sản phẩm tăng
- dần tốc độ phản ứng được xác định bằng
- sự thay đổi lượng chất đầu hoặc sản phẩm
- trong một đơn vị thời
- gian lượng chất có thể được biểu diễn
- bằng số mol nồng độ mol khối lượng hoặc
- thể tích Tuy nhiên nồng độ mol được sử
- dụng nhiều hơn cả khái niệm tốc độ phản
- ứng cũng có thể được phát biểu như sau
- tốc độ phản ứng ứng là đại lượng đặc
- trưng cho sự thay đổi nồng độ của chất
- phản ứng hoặc sản phẩm trong một đơn vị
- thời gian tốc độ phản ứng có ký hiệu là
- V đơn vị là đơn vị của nồng độ trên đơn
- vị thời gian chẳng hạn như là m trên dây
- hay là m nhân dây mũ tr-1 hay mol nhân
- lí mũ trừ 1 nhân dây mũ trừ
- 1 Cô có một ví dụ như sau xép phản ứng
- H2 + Cl2 tạo thành
- 2hcl nghiên cứu sự thay đổi nồng độ của
- một chất trong phản ứng thì thu được đồ
- thị ở hình bên có hai câu hỏi được đặt
- ra như
- sau đồ thị bên mô tả sự thay đổi nồng độ
- của chất nào và đơn vị của tốc độ phản
- ứng trong trường hợp này là gì Các em
- hãy suy nghĩ và trả lời câu hỏi này
- nhé Xin chúc mừng các em đã có câu trả
- lời chính xác từ đồ thị ta thấy nồng độ
- của chất nghiên cứu tăng dần theo thời
- gian nên chất nghiên cứu là sản phẩm
- phản ứng này lại chỉ có một sản phẩm duy
- nhất là HCl cho nên đồ thị này mô tả sự
- thay đổi nồng độ của
- HCl cũng từ đồ thị ta thấy đơn vị của
- thời gian là giây đơn vị của nồng độ là
- mol trên lí nên đơn vị của tốc độ phản
- ứng trong trường hợp này là mol trên lí
- nhân dây hay mol nhân lít mũ tr-1 nhân
- dây mũ
- tr-1 theo thời gian thì nồng độ của các
- chất phản ứng và sản phẩm thay đổi Nên
- người ta thường tính tốc độ trung bình
- của phản ứng tốc độ trung bình của phản
- ứng ký hiệu là V ngang là tốc độ Tính
- trung bình trong một khoảng thời gian
- phản ứng được tính bằng biến thiên nồng
- độ chia cho biến thiên thời gian và hệ
- số của chất trong phản ứng biến thên
- nồng độ Delta C được tính bằng nồng độ
- của chất phản ứng hoặc sản phẩm tại thời
- điểm t2 trừ đi nồng độ của chất tại thời
- điểm t1 biến thiên thời gian Delta t
- bằng hiệu của T1 và T2
- Ở đây các em cần phải lưu ý vì theo thời
- gian nồng độ các chất phản ứng dạm Dần
- nên Delta C sẽ mang giá trị âm Do đó khi
- tính tốc độ trung bình theo chất phản
- ứng cần thêm dấu trừ phía trước để đảm
- bảo giá trị tốc độ phản ứng
- Dương ví dụ cho phản ứng phân hủy n25
- như sau nồng độ của mỗi chất tại t = 0
- và T = 100 giây được cho ở trong bảng
- các em hãy tính tốc độ trung bình của
- phản ứng theo no O2 và
- n25 Xin chúc mừng các em đã có câu trả
- lời chính xác đáp án của cô như
- sau khi tính theo n25 vì đây là chất
- phản ứng nên cần có dấu trừ ở trước hệ
- số của n25 là 2 ta có 1/2 nhân với biến
- thiên nồng độ của n25 là
- 0,069 trừ
- 0,02 chia cho biến thiên thời gian là
- 100 giây
- kết quả thu được là 1,55 nh 10 mũ tr-5 m
- tr
- giây thực hiện tính tương tự với NO2 Tuy
- nhiên NO2 là sản phẩm nên không cần dấu
- trừ ở phía trước và giá trị tốc độ trung
- bình khi tính theo NO2 cũng bằng 1,55 x
- 10 mũ trừ 5 m tr
- giây Như vậy dù tính theo chất phản ứng
- hay sản phẩm thì cũng đều chỉ cho một
- giá trị tốc độ phản ứng duy nhất
- nội dung thứ hai mà chúng ta tìm hiểu
- trong Bài học này là định luật tác dụng
- khối
- lượng năm
- 1864 hai nhà bác học người Na Uy là goob
- và Go đã tìm ra định luật tác dụng khối
- lượng định luật này phát biểu như sau
- tốc độ phản ứng tỉ lệ thuận với tích
- nồng độ các chất tham gia phản ứng với
- số mũ phù hợp xét một phản ứng đơn giản
- a phản ứng với b tạo thành C và D với
- các hệ số lần lượt là a b c d thì tốc độ
- phản ứng v = k nhân với ca mũ a nhân CB
- mũ B Trong đó ca CB lần lượt là nồng độ
- của chất A và chất B tại thời điểm tính
- k là hàng số tốc độ phản ứng hàng số k
- này chỉ phụ thuộc vào nhiệt độ và bản
- chất của chất phản ứng tốc độ phản ứng
- tính theo định luật tác dụng khối lượng
- cũng chính là tốc độ tức thời của phản
- ứng tính tại một thời
- điểm chúng ta cùng xét một ví dụ cụ thể
- như sau trong phản ứng hóa học H2 + I2
- tạo thành
- 2h các em hãy viết biểu thức tính tốc độ
- tức thời của phản ứng và tính tốc độ
- phản ứng tại thời điểm nồng độ H2 và I2
- đều bằng
- 1m Xin chúc mừng các em đã có câu trả
- lời chính xác với phản ứng này tốc độ
- tức Thời v được tính bằng k nhân với
- nồng độ H2 nhân nồng độ
- I2 và tại thời điểm nồng độ H2 và I2 đều
- bằng 1 m thì tốc độ phản ứng đúng bằng
- hằng số tốc độ phản ứng K đây cũng chính
- là ý nghĩa của hàng số tốc độ phản
- ứng tổng kết lại chúng ta đã được Biết
- tốc độ phản ứng ký hiệu là v là đại
- lượng đặc trưng cho sự thay đổi nồng độ
- của chất phản ứng hoặc sản phẩm trong
- một đơn vị thời gian
- đơn vị của tốc độ phản ứng là đơn vị của
- nồng độ trên đơn vị thời
- gian tốc độ phản ứng trung bình V ngang
- là tốc độ Tính trung bình trong một
- khoảng thời gian phản ứng được tính bằng
- biến thiên nồng độ chia cho biến thiên
- thời gian và hị số của chất theo định
- luật tác dụng khối lượng tốc độ tức thời
- của phản ứng tỉ lệ thuận với tích nồng
- độ các chất tham gia phản ứng với số mũ
- phù hợp hăng số tốc độ phản ứng trong
- biểu thức của đỉnh luật tác dụ dụng khối
- lượng chỉ phụ thuộc vào bản chất của
- phản ứng và nhiệt độ khi nồng độ các
- chất phản ứng đều bằng 1 m thì hàng số
- tốc độ phản ứng có giá trị đúng bằng tốc
- độ phản
- ứng trước khi kết thúc phần một của bài
- học này cô có một câu hỏi đặt ra cho các
- em như sau tự định luật tác dụng khối
- lượng theo các em có những yếu tố nào
- ảnh hưởng đến tốc độ phản ứng hóa học
- A biểu thức định luật tác dụng khối lược
- bao gồm hàng số tốc độ phản ứng và nồng
- độ các chất phản ứng mà hằng số tốc độ
- phản ứng lại phụ thuộc vào nhiệt độ nên
- tốc độ phản ứng chịu ảnh hưởng bởi nhiệt
- độ và nồng độ chất phản ứng liệu ngoài
- hai yếu tố này còn yếu tố nào ảnh hưởng
- đến tốc độ phản ứng nữa hay không Các em
- hãy theo dõi tiếp phần hai để có câu trả
- lời
- nhé bài học của chúng ta đến đây là kết
- thúc cảm ơn các em đã theo dõi bài giảng
- các em hãy truy cập vào trang web lm.vn
- để luyện tập và đừng quên Ấn theo dõi
- kênh học trực tuyến olm nhé


Bạn có thể đánh giá bài học này ở đây