Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Thế điện cực chuẩn của kim loại SVIP
I. Cặp oxi hóa – khử của kim loại
- Nguyên tử kim loại có thể nhường electron để trở thành cation kim loại và ngược lại, cation kim loại có thể nhận electron để trở thành nguyên tử kim loại.
| Al3+ + 3e ⇌ Al | Zn2+ + 2e ⇌ Zn | Cu2+ + 2e ⇌ Cu |
- Các nguyên tử kim loại (Al, Cu, Zn,...) đóng vai trò chất khử, các ion kim loại (Al3+, Zn2+, Cu2+,...) đóng vai trò chất oxi hóa.
- Dạng oxi hóa và dạng khử tương ứng của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại. Cặp oxi hóa - khử được kí hiệu chung là oxh/kh.
Ví dụ 1: Al3+/Al; Zn2+/Zn; Cu2+/Cu;...
Tổng quát: Dạng oxi hóa (Mn+) và dạng khử (M) của cùng một kim loại tạo nên cặp oxi hóa – khử Mn+/M, giữa chúng có mối quan hệ:
Mn+ + ne ⇌ M
Lưu ý: Một kim loại có thể có nhiều cặp oxi hóa - khử và dạng khử không nhất thiết là phải là đơn chất kim loại. Ví dụ, sắt có các cặp oxi hóa khử là Fe2+/Fe và Fe3+/Fe2+.
II. Thế điện cực chuẩn của kim loại
1. Thế điện cực chuẩn
- Nhúng một thanh kim loại M vào dung dịch muối của chính kim loại đó (Mn+) tạo thành một điện cực kim loại. Trên bề mặt thanh kim loại có cân bằng sau:
Mn+(aq) + ne ⇌ M(s)
Ví dụ 2: Đối với cặp Zn2+/Zn, thiết lập được điện cực kẽm bằng cách cho thanh Zn tiếp xúc trực tiếp với dung dịch muối chứa ion Zn2+.
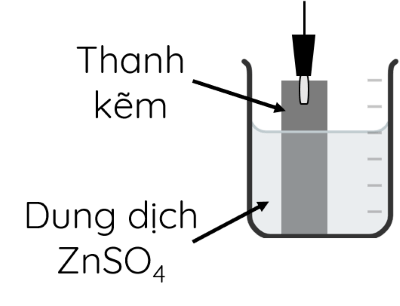
Trên bề mặt thanh kẽm tiếp xúc với dung dịch tồn tại cân bằng:
Zn2+ + 2e ⇌ Zn
- Mỗi điện cực ở điều kiện chuẩn có một đại lượng đặc trưng về điện thế, gọi là thế điện cực chuẩn.
- Thế điện cực chuẩn gắn liền với cặp oxi hóa – khử tương ứng nên thường được kí hiệu là \(E^o_{oxh/kh}\) và thường có đơn vị là volt (vôn).
- Thế điện cực chuẩn của cặp oxi hóa - khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh.
Ví dụ 3: Thế điện cực chuẩn của cặp Ag+/Ag là 0,799 V (đây là giá trị tương đối lớn đối với cặp oxi hóa - khử của kim loại), chứng tỏ tính khử của kim loại Ag yếu, tính oxi hóa của ion Ag+ mạnh.
2. Bảng thế điện cực chuẩn của kim loại và ứng dụng
- Bảng dưới đây thể hiện giá trị thế điện cực chuẩn của một số cặp oxi hóa - khử.
| Nguyên tố | Bán phản ứng | Thế điện cực chuẩn Eo (V) |
| Li | Li + 1e ⇌ Li | -3,040 |
| K | K+ + 1e ⇌ K | -2,924 |
| Ba | Ba2+ + 2e ⇌ Ba | -2,92 |
| Ca | Ca2+ + 2e ⇌ Ca | -2,84 |
| Na | Na+ + 1e ⇌ Na | -2,713 |
| Mg | Mg2+ + 2e ⇌ Mg | -2,356 |
| Al | Al3+ + 3e ⇌ Al | -1,676 |
| Zn | Zn2+ + 2e ⇌ Zn | -0,762 |
| Cr | Cr3+ + 3e ⇌ Cr | -0,74 |
| Fe | Fe2+ + 2e ⇌ Fe | -0,44 |
| H2 | 2H2O + 2e ⇌ H2 + 2OH- | -0,414 |
| Cd | Cd2+ + 2e ⇌ Cd | -0,403 |
| Ni | Ni2+ + 2e ⇌ Ni | -0,257 |
| Sn | Sn2+ + 2e ⇌ Sn | -0,137 |
| Pb | Pb2+ + 2e ⇌ Pb | -0,126 |
| H2 | 2H+ + 2e ⇌ H2 | 0,000 |
| Cu | Cu2+ + 2e ⇌ Cu | +0,340 |
| Fe | Fe3+ + 1e ⇌ Fe2+ | +0,771 |
| Ag | Ag+ + 1e ⇌ Ag | +0,799 |
| Hg | Hg2+ + 2e ⇌ Hg | +0,853 |
| Br | Br2(aq) + 2e ⇌ 2Br- | +1,087 |
| O | O2 + 4H+ + 4e ⇌ 2H2O | +1,229 |
| Cl | Cl2 (aq) + 2e = 2Cl- | +1,358 |
| Au | Au3+ + 3e ⇌ Au | +1,52 |
So sánh tính khử, tính oxi hóa giữa các cặp oxi hóa – khử:
\(E^o_{M^{n+}/M}\) càng lớn thì:
+ Tính oxi hóa của Mn+ càng mạnh.
+ Tính khử của M càng yếu.
Ví dụ 4: Thế điện cực chuẩn của cặp Zn2+/Zn và Cu2+/Cu lần lượt là -0,763 V và 0,340 V chứng tỏ tính khử của Zn mạnh hơn Cu, tính oxi hóa của Zn2+ yếu hơn Cu2+.
+ Trên cơ sở so sánh giá trị thế điện cực chuẩn, các cặp oxi hóa – khử Mn+/M được sắp xếp thành dãy theo chiều tăng dần thế điện cực chuẩn, thường gọi là dãy điện hóa của kim loại:

- Dãy điện hóa thường được sử dụng để so sánh tính khử, tính oxi hóa giữa các cặp oxi hóa – khử.
Dự đoán chiều phản ứng giữa hai cặp oxi hóa – khử
- Nguyên tắc chung của phản ứng oxi hóa - khử:
Chất oxi hóa mạnh + Chất khử mạnh → Chất khử yếu + Chất oxi hóa yếu
Biết giá trị thế điện cực chuẩn của các cặp oxi hóa - khử.
⇒ Xác định được chất oxi hóa mạnh hơn và chất khử mạnh hơn.
⇒ Dự đoán được chiều diễn ra phản ứng oxi hóa - khử ở điều kiện chuẩn.
Ví dụ 5: Do \(E^o_{Ag^+/Ag}\left(0,799V\right)>E^o_{Cu^{2+}/Cu}\left(0,340V\right)\) nên Ag+ có tính oxi hóa mạnh hơn Cu2+, Cu có tính khử mạnh hơn Ag nên ở điều kiện chuẩn xảy ra phản ứng:
Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s)
- Quy tắc alpha (α) dự đoán chiều phản ứng oxi hóa - khử theo thế điện cực chuẩn.
Ví dụ 6: Sau khi sắp xếp, hai cặp oxi hóa – khử Cu2+/Cu và Ag+/Ag theo chiều tăng dần của thế điện cực chuẩn thì vận dụng quy tắc alpha như sau:
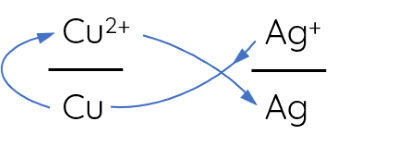
Do đó, xảy ra phản ứng hóa học: Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s).
1. Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa - khử của kim loại đó. Cặp oxi hóa khử được kí hiệu chung là oxh/kh.
2. Thế điện cực của cặp oxi hóa - khử trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1 M, ở nhiệt độ 25 oC) được gọi là thế điện cực chuẩn của kim loại, kí hiệu là \(E^o_{oxh/kh}\), thường có đơn vị là volt.
3. Nếu \(E^o_{M^{n+}/M}\) càng lớn thì tính oxi hóa của Mn+ càng mạnh, tính khử của M càng yếu và ngược lại.
4. Nếu \(E^o_{X^{m+}/X}\) < \(E^o_{Y^{n+}/Y}\) thì tính khử của X mạnh hơn Y, tính oxi hóa của Xm+ yếu hơn Yn+ và chiều của phản ứng oxi hóa - khử có thể là:
nX + mYn+ → nXm+ + mY

Bạn có thể đánh giá bài học này ở đây