Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. ĐIỀU KIỆN XẢY RA PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI
1. Phản ứng tạo thành chất kết tủa
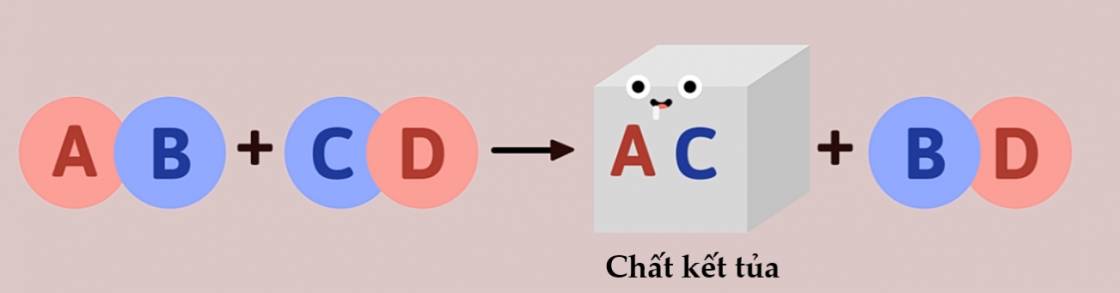
- Thí nghiệm: Nhỏ dung dịch natri sunfat Na2SO4 vào ống nghiệm đựng dung dich BaCl2 thấy kết tủa BaSO4 xuất hiện.
Na2SO4 + BaCl2 → BaSO4 + 2NaCl (1)
- Giải thích: Trong dung dịch Na2SO4 và BaCl2 đều phân li mạnh.
Na2SO4 → 2Na+ + SO42-
BaCl2 → Ba2+ + 2Cl-
Sau đó hai ion Ba2+ và SO42- kết hợp với nhau tạo thành kết tủa BaSO4, nên thực chất phản ứng trong dung dịch là:
Ba2+ + SO42- → BaSO4 (2)
Phương trình (2) được gọi là phương trình ion rút gọn của phản ứng (1).
Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li.
- Cách chuyển phương trình phân tử thành phương trình ion rút gọn.
Ví dụ: AgNO3 + HCl → AgCl↓ + HNO3
Bước 1: Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion tương ứng, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử. Phương trình thu được là phương trình ion đầy đủ.
Ag+ + NO3- + H+ + Cl- → AgCl + H+ + NO3-
Bước 2: Lược bỏ những ion không tham gia phản ứng, ta được phương trình ion rút gọn.
Ag+ + Cl- → AgCl
Từ phản ứng này ta thấy rằng, muốn điều chế AgCl, cần trộn hai dung dịch, một dung dịch chứa ion Ag+ và một dung dịch chứa ion Cl-.
2. Phản ứng tạo thành chất điện li yếu
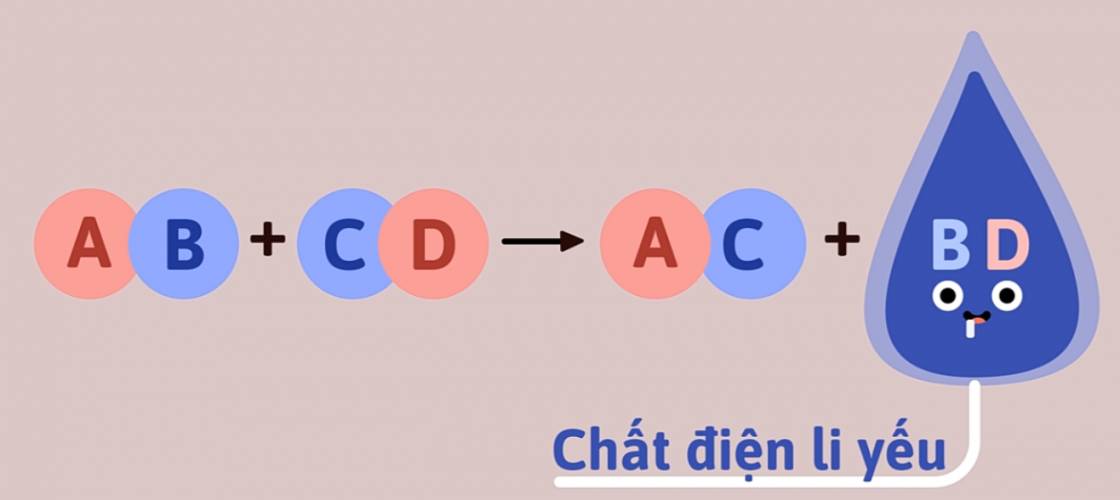
a. Phản ứng tạo thành nước
- Thí nghiệm: Nhỏ vài giọt dung dịch phenolphtalein vào cốc đựng dung dịch NaOH 0,1M, dung dịch chuyển sang màu hồng. Rót từ từ dung dịch HCl 0,1M vào cốc trên, vừa rót vừa khuấy, cho đến khi mất màu. Phản ứng như sau:
HCl + NaOH → NaCl + H2O
- Giải thích: NaOH và HCl đều dễ tan và phân li mạnh trong nước:
NaOH → Na+ + OH-
HCl → H+ + Cl-
Các ion OH- trong dung dịch làm cho phenolphtalein chuyển sang màu hồng. Khi cho dung dịch HCl vào, các ion H+ do HCl phân li ra sẽ phản ứng với ion OH- của NaOH tạo thành chất điện li rất yếu là H2O. Phương trình ion rút gọn:
H+ + OH- → H2O
Khi màu của dung dịch mất hẳn, đó cũng là lúc ion OH- đã phản ứng hết với ion H+.
Phản ứng giữa dung dịch axit và hidroxit có tính bazơ rất dễ xảy ra vì tạo thành chất điện li rất yếu là H2O. Chẳng hạn Mg(OH)2 rất ít tan trong nước, nhưng dễ dàng tan trong dung dịch axit mạnh:
Mg(OH)2 (r) + 2H+ → Mg2+ + H2O
b. Phản ứng tạo thành axit yếu
- Thí nghiệm: Nhỏ dung dịch HCl vào ống nghiệm đựng dung dịch CH3COONa, thu được axit yếu CH3COOH.
HCl + CH3COONa → CH3COOH + NaCl
- Giải thích: HCl và CH3COONa là các chất dễ tan và phân li mạnh:
HCl → H+ + Cl-
CH3COONa → CH3COO- + Na+
Trong dung dịch, các ion H+ sẽ kết hợp với ion CH3COO- tạo thành chất điện li yếu là CH3COOH. Phương trình ion rút gọn:
CH3COO- + H+ → CH3COOH
3. Phản ứng tạo thành chất khí
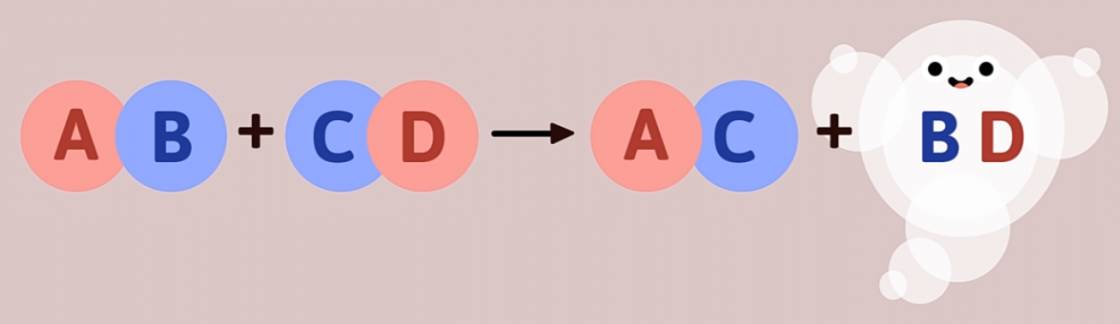
- Thí nghiệm: Rót dung dịch HCl vào cốc đựng dung dịch Na2CO3 ta thấy có bọt khí thoát ra:
2HCl + Na2CO3 → NaCl + CO2 + H2O
- Giải thích: HCl và Na2CO3 đều dễ tan và phân li mạnh:
HCl → H+ + Cl-
Na2CO3 → 2Na+ + CO32-
Các ion H+ và CO32- trong dung dịch kết hợp với nhau tạo thành axit yếu là H2CO3, axit này không bền phân hủy ra thành CO2 và H2O.
H+ + CO32- → HCO3-
H+ + HCO3- → H2CO3
H2CO3 → CO2 + H2O
Phương trình ion rút gọn: 2H+ + CO32- → CO2 + H2O
Phản ứng giữa muối cacbonat và dung dịch axit yếu rất dễ xảy ra vì vừa tạo thành chất điện li yếu là H2O, vừa tạo ra chất khí là CO2 tách khỏi dung dịch.
II. KẾT LUẬN
1. Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
2. Phản ứng trao đổi trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
- chất kết tủa.
- chất điện li yếu (H2O, NH3 ...).
- chất khí.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây