Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP

A. ANĐEHIT
I. ĐỊNH NGHĨA, PHÂN LOẠI, DANH PHÁP
1. Định nghĩa
- Anđehit là những hợp chất hữu cơ mà phân tử có nhóm -CH=O liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hidro.
- Nhóm -CH=O là nhóm chức andehit.
Ví dụ: H-CH=O anđehit fomic; CH3-CH=O anđehit axetic; 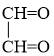 anđehit oxalic.
anđehit oxalic.
2. Phân loại
Dựa vào đặc điểm của gốc hidrocacbon mà nhóm chức -CH=O gắn vào và theo số lượng nhóm chức -CH=O trong phân tử, người ta chia andehit thành các loại sau:
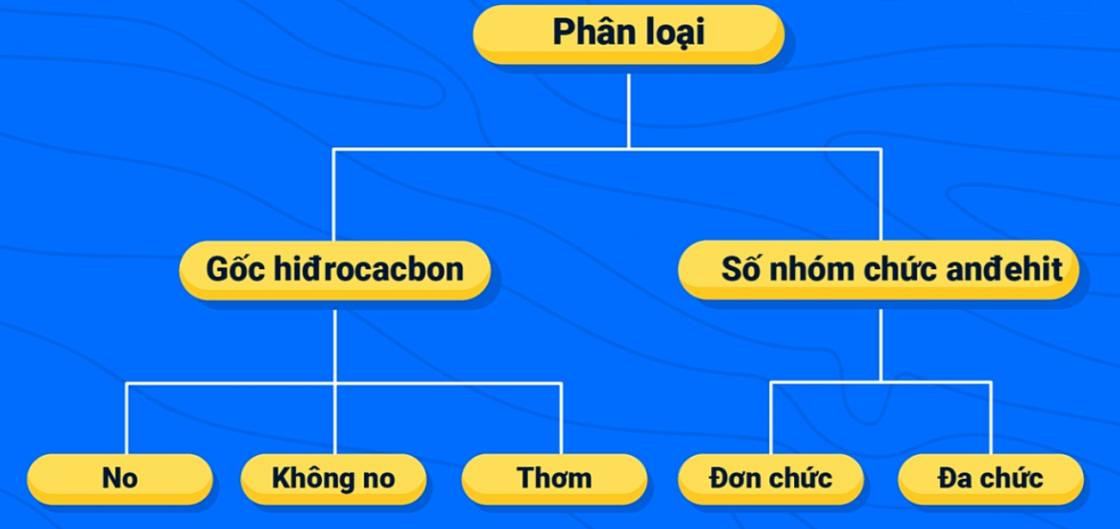
Ví dụ: Anđehit no, đơn chức, mạch hở là hợp chất trong phân tử gồm 1 nhóm -CH=O liên kết với gốc ankyl hoặc nguyên tử hidro. Dãy đồng đẳng của chúng có công thức cấu tạo thu gọn là CnH2n+1CHO (n≥0) hay công thức phân tử là CnH2nO (n≥1).
3. Danh pháp
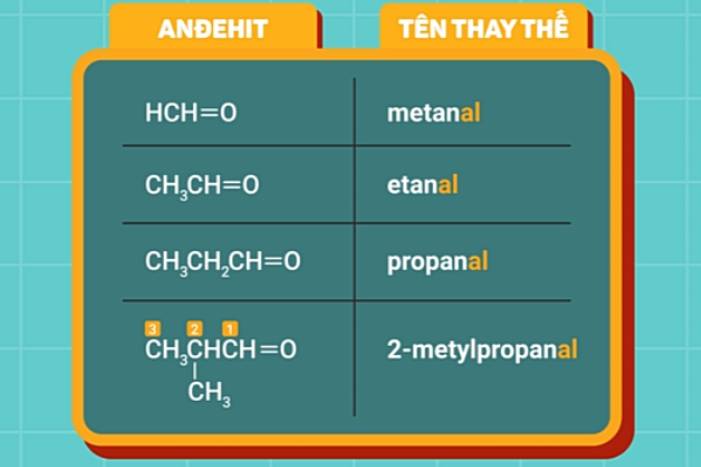
Tên thay thế của các anđehit no, đơn chức, mạch hở có cấu tạo như sau:
| Tên hidrocacbon no tương ứng với mạch chính + "al" |
Lưu ý:
- Mạch chính của phân tử anđehit là mạch cacbon dài nhất bao gồm cả nhóm -CH=O.
- Khi đánh số thứ tự mạch chính, luôn bắt đầu từ nguyên tử cacbon của nhóm -CH=O.
Ví dụ: Tên thay thế của một số anđehit no, đơn chức.
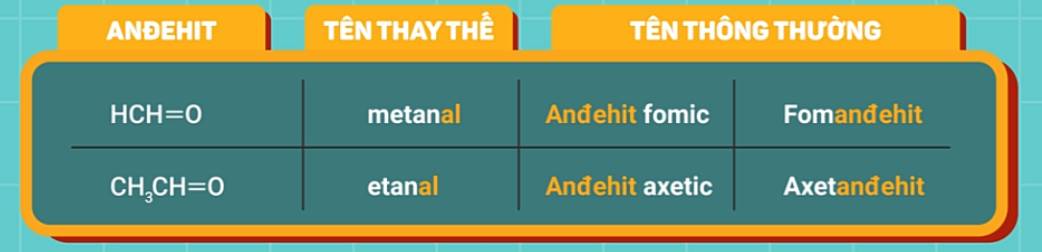
Ngoài ra, một số anđehit phổ biến còn được gọi bằng tên thông thường như:
II. ĐẶC ĐIỂM CẤU TẠO, TÍNH CHẤT VẬT LÝ
1. Đặc điểm cấu tạo
Nhóm -CHO có cấu tạo như sau: ![]()
Trong nhóm -CH=O, liên kết đôi C=O bao gồm 1 liên kết π kém bền và 1 liên kết σ bền hơn tương tự như liên kết đôi C=C trong phân tử anken, do đó andehit có một số tính chất giống anken.
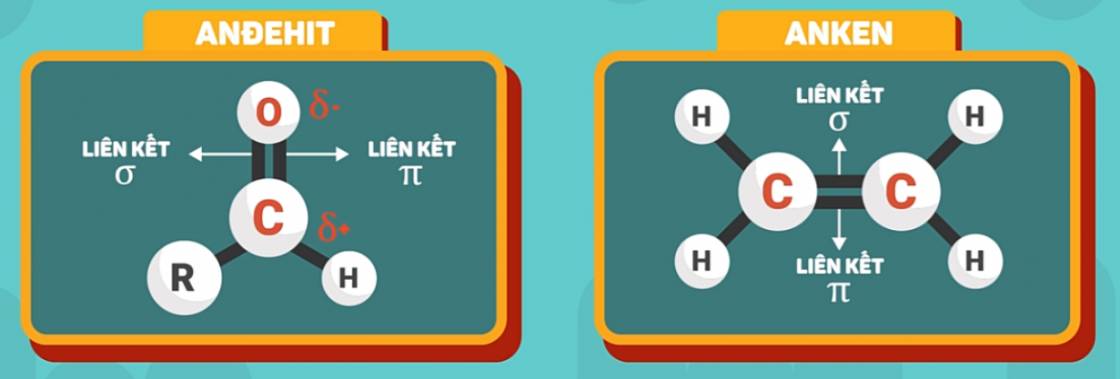
Tuy nhiên, liên kết đôi C=O có sự phân cực, còn liên kết đôi C=C thì không vì oxi có độ âm điện lớn hơn cacbon, cho nên ngoài ra anđehit cũng có những tính chất riêng mà anken không có.
2. Tính chất vật lý
- Hai anđehit đầu dãy đồng đẳng là HCHO, CH3CHO là chất khí ở điều kiện thường và tan tốt trong nước, các anđehit kế tiếp là chất lỏng hoặc rắn, độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
- Dung dịch nước của anđehit gọi là fomon. Dung dịch bão hòa của anđehit fomic (có nồng độ 37-40%) gọi là fomalin.
- Do không tạo được liên kết hidro liên phân tử nên các anđehit có nhiệt độ sôi, nhiệt độ nóng chảy thấp hơn tương đối nhiều so với các ancol tương ứng có cùng số nguyên tử cacbon.

III. TÍNH CHẤT HÓA HỌC
1. Phản ứng cộng hidro
Hidro cộng vào liên kết đôi C=O tương tự như cộng vào liên kết đôi C=C.
Ví dụ: CH3-CH=O + H2  CH3CH2-OH
CH3CH2-OH
Tổng quát:
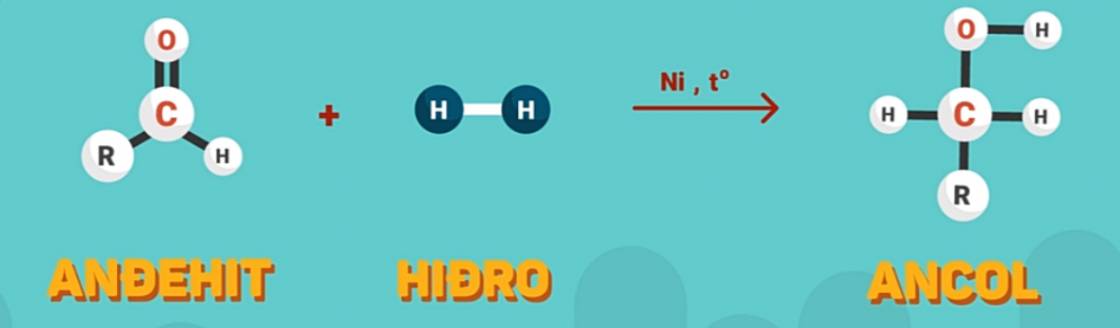
Trong các phản ứng trên, anđehit đóng vai trò là chất oxi hóa.
2. Phản ứng oxi hóa không hoàn toàn
Thí nghiệm: Cho vào ống nghiệm 1 ml dung dich AgNO3 1%, sau đó thêm dần từng giọt dung dịch NH3, đồng thời lắc đều đến khi thu được dung dịch trong suốt thì dừng lại.
Thêm tiếp vài giọt anđehit axetic rồi đun nóng nhẹ. Sau một thời gian ngắn, thấy có một lớp bạc bám xung quanh thành ông nghiệm.
Phương trình phản ứng:
CH3-CHO + 2AgNO3 + 3NH3 + H2O ![]() CH3-COONH4 + 2Ag↓ + NH4NO3
CH3-COONH4 + 2Ag↓ + NH4NO3
Trong phản ứng trên, ion Ag+ đã bị khử thành nguyên tử Ag, anđehit axetic là chất khử.
Phản ứng trên cũng được gọi là phản ứng tráng bạc vì người ta dùng phương pháp này để tráng một lớp Ag trên mặt kính làm gương soi, tráng ruột phích,...
Dung dịch AgNO3/NH3 cũng là thuốc thử để nhận biết anđehit.

Phương trình tổng quát:
R-(CHO)n + 2nAgNO3 + 3nNH3 + nH2O ![]() R-(COONH4)n + 2nAg ↓ + 2nNH4NO3
R-(COONH4)n + 2nAg ↓ + 2nNH4NO3
Ta có: \(\dfrac{nAg}{nAnđehit}\) = 2n với n là số nhóm chức -CH=O của anđehit.
Lưu ý: Anđehit fomic là anđehit đơn chức duy nhất khi tham gia phản ứng tráng gương cho tỉ lệ \(\dfrac{nAg}{nAnđehit}\) = 4 do anđehit fomic tham gia phản ứng tráng gương theo phương trình sau:
HCHO + 2AgNO3 + 3NH3 + H2O ![]() HCOONH4 + 2Ag + 2NH4NO3 (1)
HCOONH4 + 2Ag + 2NH4NO3 (1)
Muối HCOONH4 vừa sinh ra do vẫn còn nhóm -CHO nên có thể tiếp tục tham gia phản ứng tráng bạc:
HCOONH4 + 2AgNO3 + 3NH3 + H2O ![]() NH4(CO3)2 + 2Ag + 2NH4NO3 (2)
NH4(CO3)2 + 2Ag + 2NH4NO3 (2)
(1) + (2) => HCHO + 4AgNO3 + 6NH3 + 2H2O ![]() NH4(CO3)2 + 4Ag + 4NH4NO3
NH4(CO3)2 + 4Ag + 4NH4NO3
Anđehit có thể bị oxi hóa bởi nhiều tác nhân khác như dung dịch Br2, O2, dung dịch KMnO4...
Ví dụ:
2RCHO + O2 ![]() 2RCOOH
2RCOOH
RCHO + Br2 + H2O → RCOOH + 2HBr
Trong các phản ứng trên, anđehit đóng vai trò là chất khử.
Anđehit vừa thể hiện tính oxi hóa vừa thể hiện tính khử trong các phản ứng hóa học.
IV. ĐIỀU CHẾ
1. Từ ancol
Oxi hóa ancol bậc I thu được andehit tương ứng:
R-CH2OH + CuO 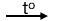 R-CHO + Cu + H2O
R-CHO + Cu + H2O
2. Từ hidrocacbon
Trong công nghiệp, anđehit fomic được điều chế từ metan:
CH4 + O2 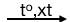 HCHO + H2O
HCHO + H2O
Phương pháp hiện đại hiện nay để sản xuất anđehit axetic là oxi hóa không hoàn toàn etilen:
2CH2=CH2 + O2 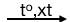 2CH3-CHO
2CH3-CHO
Anđehit axetic cũng được điều chế từ axetilen bằng phản ứng cộng nước:
CHΞCH + H2O 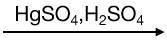 CH3CHO
CH3CHO
V. ỨNG DỤNG
- Fomanđehit dùng làm nhiên liệu để sản xuất nhựa phenol-fomanđehit, nhựa ure-fomanđehit.
- Dung dịch fomon được dùng làm chất tẩy uế, ngâm tẩm bảo quản mẫu động vật, dùng trong kĩ nghệ da giày.

- Anđehit có nguồn gốc thiên nhiên được dùng làm hương liệu trong công nghiệp thực phẩm, mĩ phẩm.

B. XETON
I. ĐỊNH NGHĨA
Xeton là những hợp cơ mà phân tử có nhóm ![]() liên kết trực tiếp với hai nguyên tử cacbon.
liên kết trực tiếp với hai nguyên tử cacbon.
Ví dụ:
CH3-CO-CH3 (đimetyl xeton) CH3-CO-C6H5 (metyl phenyl xeton) CH3-CO-CH=CH2 (metyl vinyl xeton)
II. TÍNH CHẤT HÓA HỌC
Tượng tự anđehit, xeton cộng hidro tạo thành ancol:
R-CO-R1 + H2 ![]() R-CH(OH)-R1
R-CH(OH)-R1
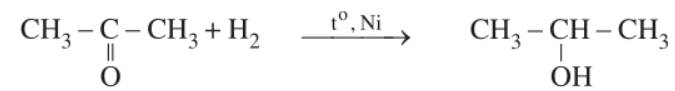
Do không có nhóm -CH=O nên xeton không có phản ứng tráng bạc như anđehit.
III. ĐIỀU CHẾ
- Từ ancol
Oxi hóa không hoàn toàn ancol bậc II thu được xeton:
R-CH(OH)-R1 + CuO ![]() R-CO-R1 + Cu + H2O
R-CO-R1 + Cu + H2O
CH3-CH(OH)-CH3 + CuO ![]() CH3-CO-CH3 + H2O + Cu
CH3-CO-CH3 + H2O + Cu
- Từ hidrocacbon
Oxi hóa không hoàn toàn cumen thu được axeton và phenol theo sơ đồ:
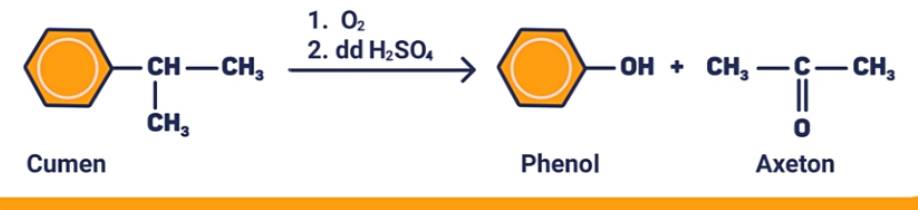
VI. ỨNG DỤNG
Axeton được dùng làm dung môi trong quá trình sản xuất nhiều hợp chất trong công nghiệp mĩ phẩm, làm nguyên liệu tổng hợp clorofom, iodofom,...
Xiclohexanon 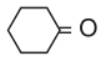 được dùng làm nguyên liệu sản xuất một số vật liệu polime như tơ capron , nilon-6,6.
được dùng làm nguyên liệu sản xuất một số vật liệu polime như tơ capron , nilon-6,6.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cộng đồng Hoc24.vn cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây
