Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. TÍNH KIM LOẠI, TÍNH PHI KIM
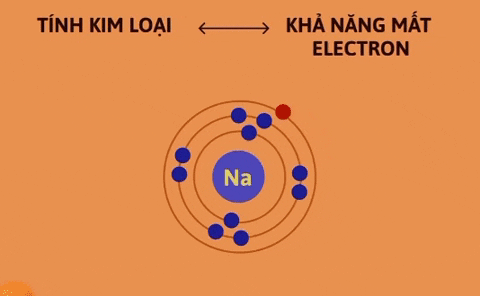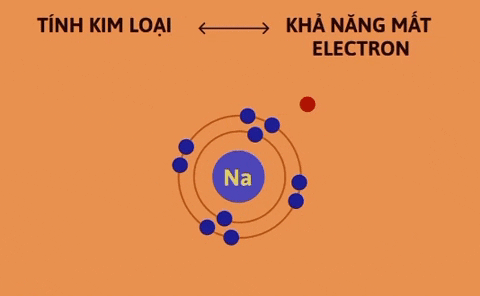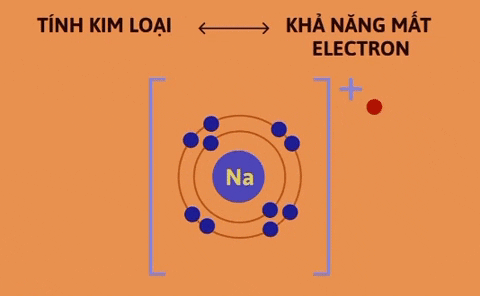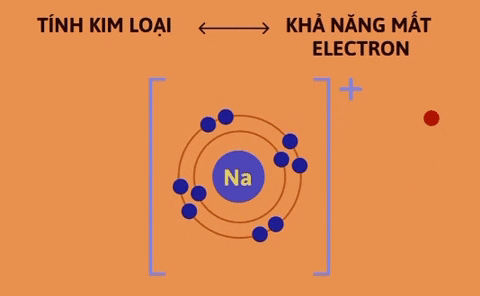
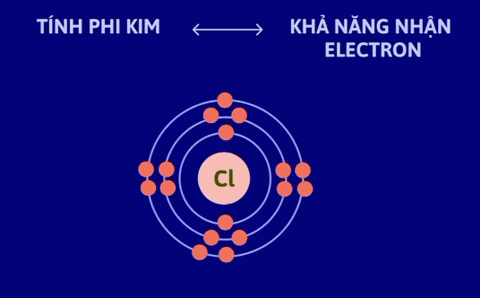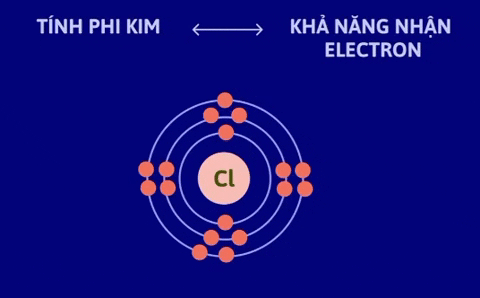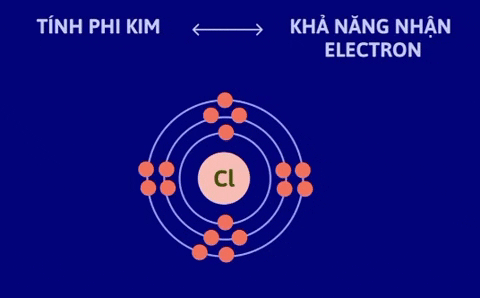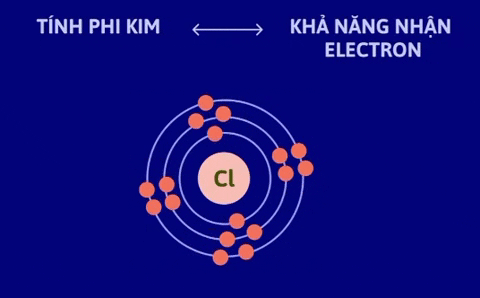
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ mất electron để trở thành ion dương. Nguyên tử càng dễ mất electron, tính kim loại của nguyên tố càng mạnh. | Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm. Nguyên tử càng dễ nhận electron thì tính phi kim của nguyên tố càng mạnh. |
|
|
Không có ranh giới rõ rệt giữa tính kim loại và tính phi kim.
1. Sự biến đổi tính chất trong một chu kì
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố yếu dần, đồng thời tính phi kim mạnh dần.
Nguyên nhân là trong một chu kì, khi đi từ trái sang phải, điện tích hạt nhân tăng dần nhưng số lớp electron của nguyên tử các nguyên tố không thay đổi, do đó lực hút giữa hạt nhân và các electron lớp ngoài cùng tăng dần làm cho bán kính nguyên tử giảm dần, nên khả năng nhường electron (đặc trưng cho tính kim loại của nguyên tố) giảm dần, khả năng nhận electron (đặc trưng cho tính phi kim của nguyên tố) tăng dần.

Bán kính nguyên tử của một số nguyên tố.
2. Sự biến đổi tính chất trong một nhóm A
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố mạnh dần, đồng thời tính phi kim yếu dần.
Do trong một nhóm A, khi đi từ trên xuống dưới, điện tích hạt nhân tăng và số lớp electron cũng tăng làm cho bán kính nguyên tử của các nguyên tố tăng nhanh nên khả năng nhường electron của các nguyên tử càng tăng lên (tính kim loại tăng) và khả năng nhận electron của các nguyên tử giảm (tính phi kim giảm).
Kết luận: Tính kim loại - phi kim biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt nhân.
3. Độ âm điện
a. Khái niệm
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
- Độ âm điện của nguyên tử càng lớn thì tính phi kim của nguyên tử đó càng mạnh. Ngược lại, độ âm điện của nguyên tử càng nhỏ thì tính phi kim của nó càng yếu và tính kim loại càng mạnh.
b. Bảng độ âm điện
- Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân thì độ âm điện của các nguyên tử nói chung tăng dần.
- Trong một nhóm A, đi từ trên xuống theo chiều tăng dần của điện tích hạt nhân thì độ âm điện của các nguyên tử nói chung giảm dần.
Kết luận: Độ âm điện của các nguyên tố biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt nhân.
II. HÓA TRỊ CỦA CÁC NGUYÊN TỐ
- Hóa trị cao nhất của các nguyên tố với oxi bằng số thứ tự nhóm (tăng từ 1 đến 7).
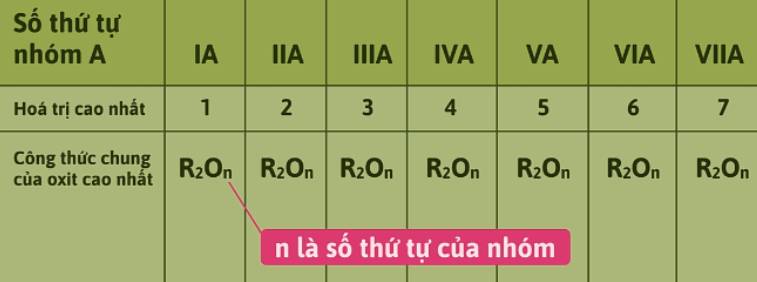
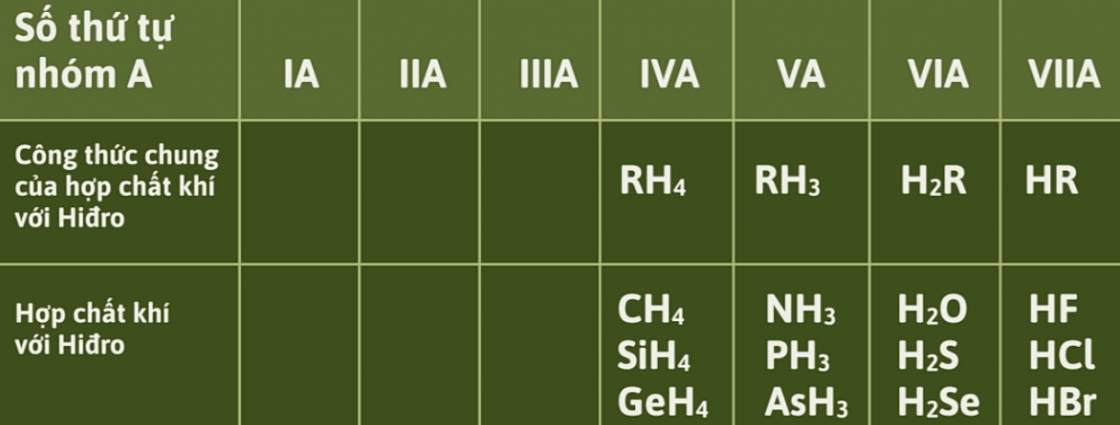
- Từ nhóm IVA đến VIIA, hóa trị cao nhất của các nguyên tố với hidro bằng 8 - số thứ tự nhóm (giảm từ 4 đến 1).
III. OXIT VÀ HIDROXIT CỦA CÁC NGUYÊN TỐ NHÓM A THUỘC CÙNG CHU KÌ
Trong một chu kì, đi từ trái sang phải theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hidroxit tương ứng yếu dần, đồng thời tính axit của chúng mạnh dần.

IV. ĐỊNH LUẬT TUẦN HOÀN
Định luật tuần hoàn về các nguyên tố hóa học được phát biểu như sau: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây