Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. SỰ HÌNH THÀNH ION, CATION, ANION
1. Ion, cation và anion
a. Nguyên tử trung hòa về điện. Khi nguyên tử nhường hay nhận electron, nó trở thành phần tử mang điện gọi là ion.
b. Trong các phản ứng hóa học, để đạt cấu hình electron bền của khí hiếm, nguyên tử kim loại có xu hướng nhường electron cho nguyên tử các nguyên tố khác để trở thành ion dương, gọi là cation.
Ví dụ 1: Sự hình thành cation Mg2+ từ nguyên tử Mg (Z = 12). Cấu hình electron của Mg là 1s22s22p63s2. Nguyên tử Mg dễ nhường đi 2 electron ở lớp ngoài cùng để trở thành ion dương.

Ví dụ 2: Quá trình hình thành cation của K, Ca, Al
K → K+ + e
Ca → Ca2+ + 2e
Al → Al3+ + 3e
Các cation kim loại được gọi theo tên của kim loại tương ứng. Ví dụ, Na+ gọi là cation natri, Ca2+ goi là cation canxi 2+.
c. Sự tạo thành anion
Trong các phản ứng hóa học, để đạt cấu hình electron bền vững của khí hiếm, các nguyên tử phi kim có xu hướng nhận electron từ nguyên tử các nguyên tố khác để trở thành ion âm, gọi là anion.
Ví dụ 3: Sự tạo thành ion florua F- từ nguyên tử F (Z = 9).
Cấu hình electron của F là 1s22s22p5, lớp ngoài cùng có 7 electron nên dễ nhận thêm 1 electron trở thành ion F- để đạt cấu hình electron bền vững của khí hiếm.

Ví dụ 4: Quá trình hình thành anion của O, Cl, N.
Cl + 1e → Cl-
O + 2e → O2-
N + 3e → N3-
Tên của anion được gọi theo tên gốc axit (trừ O2– gọi là anion oxit). Ví dụ: F– gọi là anion florua.
2. Ion đơn nguyên tử và ion âm đa nguyên tử
a. Ion đơn nguyên tử là ion tạo nên từ một nguyên tử. Ví dụ như: cation Li+, Na+, Mg2+, Al3+, anion F-, S2-.
b. Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm. Ví dụ: cation amoni NH4+, anion hidroxit OH–, anion sunfat SO42–...
II. SỰ TẠO THÀNH LIÊN KẾT ION
Ta xét quá trình hình thành phân tử NaCl.
Nguyên tử Na (1s22s22p63s1) có một electron lớp ngoài cùng nên có xu hướng nhường đi 1 electron để trở thành ion Na+. Nguyên tử Cl (1s22s22p63s23p5) có 7 electron lớp ngoài cùng nên có xu hướng nhận thêm 1 electron để trở thành ion Cl-, do đó Cl sẽ nhận 1 electron từ Na nhường, giúp cả 2 đều đạt được cấu hình electron bền vững.
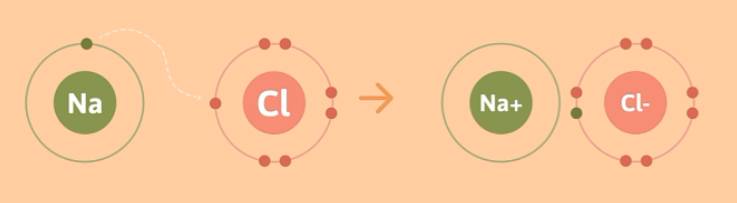
Na + Cl → Na+ + Cl-
Hai ion được tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl.
Na+ + Cl- → NaCl
Liên kết giữa cation Na+ và anion Cl- là liên kết ion.
Vậy, liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Liên kết ion được hình thành giữa một kim loại điển hình và một phi kim điển hình.
III. TINH THỂ ION
1. Tinh thể NaCl
Ở thể rắn, NaCl tồn tại dưới dạng tinh thể ion. Trong mạng tinh thể NaCl, các ion Na+ và Cl- được phân bố luân phiên đều đặn trên các đỉnh của các hình lập phương nhỏ. Xung quanh mỗi ion đều có 6 ion ngược dấu gần nhất.
![LỜI GIẢI] Dưới đây là hình vẽ một ô mạng tinh thể muối NaCl Số phân tử - Tự Học 365](https://tuhoc365.vn/wp-content/uploads/2020/03/24_7.png)
Mô hình tinh thể natri clorua.
2. Tính chất chung của hợp chất ion
Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn. Các hợp chất ion đều khá rắn, khó bay hơi, khó nóng chảy.
Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy và khi hòa tan trong nước, chúng dẫn điện, còn ở trạng thái rắn thì không dẫn điện.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây