Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. KIẾN THỨC CẦN NHỚ
1. Tính chất hóa học của kim loại
Dãy hoạt động hóa học của kim loại:

Kim loại có thể phản ứng với phi kim, phản ứng với nước, phản ứng với dung dịch axit và phản ứng với dung dịch muối.
Phản ứng với phi kim | Phản ứng với nước |
Một số kim loại có thể tác dụng với oxi và các phi kim khác sinh ra sản phẩm là các oxit hoặc muối tương ứng. 2Mg + O2 2Fe+ 3Cl2 | Các kim loại hoạt ở đầu dãy hoạt động của kim loại như K, Na, Ca... có thể phản ứng với nước ở nhiệt độ thường sinh ra bazơ và giải phóng khí hidro. 2Na + 2H2O → 2NaOH + H2 |
Tác dụng với dung dịch axit | Tác dụng với dung dịch muối |
HCl, H2SO4 loãng: Chỉ những kim loại đứng trước hidro trong dãy hoạt động hóa học mới phản ứng được với dung dịch axit HCl hoặc H2SO4 loãng. Fe + 2HCl → FeCl2 + H2 HNO3 ,H2SO4 đặc: Phản ứng được với hầu hết các kim loại trừ Au, Pt nhưng không giải phóng khí H2. Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2↑ + 2H2O Lưu ý: Al, Fe không tác dụng với dung dịch HNO3 đặc, nguội, H2SO4 đặc, nguội. | Các kim loại hoạt động mạnh hơn (trừ Na, K, Ca...) có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới. Zn + CuSO4 → ZnSO4 + Cu↓ |
2. Tính chất hóa học của nhôm và sắt có gì giống và khác nhau?
| Giống nhau | Khác nhau |
|
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Ví dụ: FeCl2, FeCl3... |
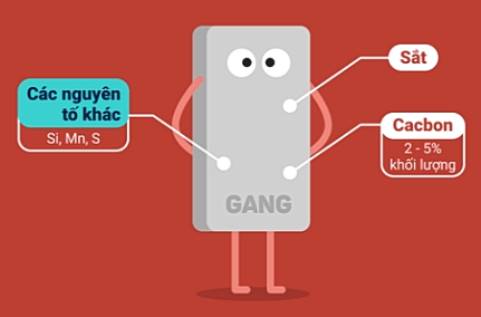
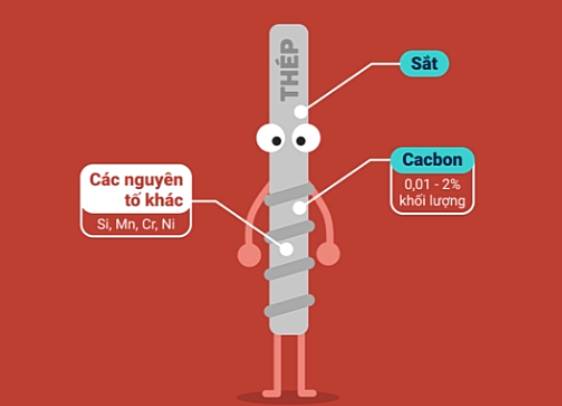
3. Hợp kim của sắt
| Gang | Thép | |
| Thành phần |
|
|
| Tính chất | Giòn, không rèn, không dát mỏng được. | Đàn hồi, dẻo (rèn, dát mỏng, kéo sợi được), cứng. |
| Sản xuất | Trong lò cao. Nguyên tắc: dùng CO khử các oxit sắt ở nhiệt độ cao. 3CO + Fe2O3 | Trong lò luyện thép. Nguyên tắc: Oxi hóa các nguyên tố C, Mn, Si, S, P,... có trong gang. FeO + C |
4. Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- Sự phá hủy kim loại, hợp kim do tác dụng hóa học trong môi trường được gọi là sự ăn mòn kim loại.
- Những yếu tố ảnh hướng tới sự ăn mòn kim loại đó là ảnh hưởng của các chất có trong môi trường và nhiệt độ của môi trường...
- Có 2 biện pháp chính để bảo vệ kim loại không bị ăn mòn là: ngăn không cho kim loại tiếp xúc với môi trường và chế tạo các hợp kim ít bị ăn mòn.
Ví dụ: Để bảo vệ các hàng rào bằng sắt để ngoài môi trường không bị ăn mòn, người ta sơn lên hàng rào bằng các loại sơn đặc biệt để ngăn các tác nhân ăn mòn trong môi trường như nước mưa, oxi, hơi ẩm có thể tiếp xúc với hàng rào và gây ra sự ăn mòn kim loại. Hay người ta sản xuất các dụng cụ nhà bếp bằng các hợp kim ít bị ăn mòn như thép, inox giúp chúng không bị ăn mòn khi đun nấu, tẩy rửa.


II. BÀI TẬP
Bài 1: Hoàn thành chuỗi phản ứng sau: FeCl3 → Fe(OH)3 → Fe2O3 → Fe → Fe3O4
Lời giải
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Fe(OH)3 ![]() Fe2O3 + H2O
Fe2O3 + H2O
Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
Fe + O2 ![]() Fe3O4
Fe3O4
Bài 2: Cho 4,8 gam một kim loại X có hóa trị II tác dụng với dung dịch axit clohidric HCl dư. Sau phản ứng thấy thu được 4,48 lít khí H2 ở đktc. Xác định kim loại X.
Lời giải
Phương trình phản ứng:
X + 2HCl → XCl2 + H2
nH2 = \(\dfrac{4,48}{22,4}\) = 0,2 mol => nX = nH2 = 0,2 mol
MX = \(\dfrac{m_X}{n_X}\) = \(\dfrac{4,8}{0,2}\) = 24 (g/mol)
Vậy kim loại X là Magie (Mg)
Bài 3: Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.
Lời giải
Fe + CuSO4 → FeSO4 + Cu
Khi cho đinh sắt vào dung dịch CuSO4, sắt phản ứng với dung dịch muối và đấy kim loại đồng ra khỏi dung dịch. Đồng sinh ra bám vào đinh sắt.
Khối lượng đinh sắt tăng = mCu bám vào - mFe tan ra = 0,8 gam.
Gọi số mol Fe đã phản ứng (tan ra) là x mol. Theo phương trình phản ứng => nCu = nFe = x mol
Ta có: 64x - 56x = 0,8
<=> 8x = 0,8
<=> x = 0,1
=> nCuSO4 phản ứng = nFe = 0,1 mol
<=> MCuSO4 = \(\dfrac{0,1}{0,2}\) = 0,5 M
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây