Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
Rượu là một loại đồ uống phổ biến trong cuộc sống, vậy rượu có công thức hóa học và tính chất gì? cách để điều chế rượu? Chúng ta cùng tìm hiểu ở bài học dưới đây.
Công thức phân tử: C2H6O
Phân tử khối: 46
I. CẤU TẠO PHÂN TỬ
Rượu etylic có công thức cấu tạo: 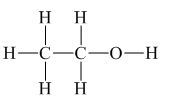 . Viết gọn CH3-CH2-OH hay C2H5OH.
. Viết gọn CH3-CH2-OH hay C2H5OH.
Khác với các hidrocacbon đã học, ta thấy trong phân tử rượu etylic có một nguyên tử H không liên kết với C mà liên kết với nguyên tử O tạo thành nhóm -OH. Chính nhóm -OH làm cho rượu có tính chất đặc trưng riêng so với các hidrocacbon.
.gif)
II. TÍNH CHẤT VẬT LÍ
Về mặt trạng thái: Rượu etylic (ancol etylic hoặc etanol) là chất lỏng, không màu ở nhiệt độ thường, sôi ở 78,3oC.
Là dung môi hữu cơ có thể hòa tan được nhiều chất như iot, benzen, axit axetic...
Tính tan: Nhẹ hơn nước và tan vô hạn trong nước.

Rượu etylic được sử dụng trong cuộc sống hàng ngày thường không phải rượu nguyên chất mà là dung dịch rượu gồm rượu pha với nước. Người ta dùng khái niệm độ rượu để biểu thị cho hàm lượng ancol etylic có trong dung dịch rượu nhiều hay ít.
Định nghĩa: Số ml rượu ancol etylic có trong 100ml hỗn hợp rượu và nước được gọi là độ rượu.
Ví dụ: Trong 100ml rượu có 45ml rượu ancol etylic còn lại 55ml là nước thì đây là rượu 45o hay ngược lại, trong 100ml rượu 30o thì có 30ml rượu ancol etylic và 70ml nước.

III. TÍNH CHẤT HÓA HỌC
1. Phản ứng với natri
Thí nghiệm: Cho vào ống nghiệm 5ml ancol etylic, thêm tiếp vào ống nghiệm một mẩu natri nhỏ bằng hạt ngô và quan sát.
Hiện tượng: Có bọt khí không màu bay lên khỏi ống nghiệm, đưa mẩu giấy đang cháy lại gần miệng ống nghiệm thấy có tiếng nổ xuất hiện và hơi nước ngưng tụ trên miệng ống.
Kết luận: Tương tự nước, ancol etylic tác dụng với natri giải phóng ra khí hidro.
Phương trình hóa học: 2C2H5OH + 2Na → 2C2H5ONa + H2↑
2. Phản ứng cháy
Thí nghiệm: Nhỏ vài giọt rượu etylic vào chén sứ rồi đốt, thấy rượu etylic cháy với ngọn lửa màu xanh tỏa nhiều nhiệt.
Kết luận: Rượu etylic tác dụng mạnh với oxi khi đốt nóng.
Phương trình hóa học: C2H6O + 3O2  2CO2 + 3H2O
2CO2 + 3H2O
3. Phản ứng với axit axetic
Ancol etylic phản ứng với dung dịch axit axetic CH3COOH với xúc tác là axit sunfuric đặc tạo thành etyl axetat và nước. Phản ứng là phản ứng thuận nghịch.
 CH3COOC2H5 (Etyl axetat) + H2O
CH3COOC2H5 (Etyl axetat) + H2O
IV. ĐIỀU CHẾ, ỨNG DỤNG
1. Điều chế
Rượu etylic thường được điều chế theo hai cách sau:
Tinh bột hoặc đường \(\underrightarrow{lên-men}\) Rượu etylic
hoặc C2H4 + H2O  C2H5OH
C2H5OH
2. Ứng dụng
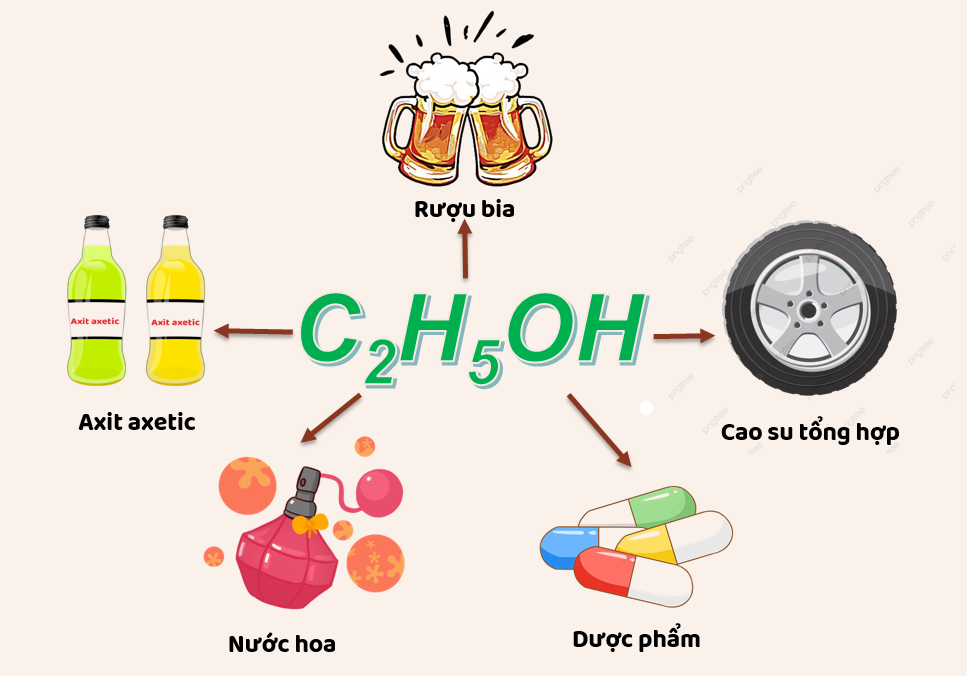
Rượu etylic có rất nhiều ứng dụng, phổ biến nhất là dùng làm đồ uống, ngày nay y học đã công nhận lợi ích của rượu thuốc (rượu ngâm các loại thảo mộc và động vật làm thuốc). Một cốc rượu thuốc (30-50ml) trong bữa ăn sẽ giúp kích thích tiêu hóa, ăn uống ngon miệng hơn.Tuy nhiên, nếu lạm dụng và uống quá nhiều rượu sẽ gây tổn thương gan, dạ dày, thần kinh, lâu dần sẽ nguy hiểm đến tính mạng. Vì vậy phải sử dụng rượu một cách hợp lý và vừa phải.
V. TỔNG KẾT
1. Rượu etylic là chất lỏng, không màu, tan vô hạn trong nước. Độ rượu là số ml rượu etylic có trong 100ml hỗn hợp rượu và nước.
2. Công thức cấu tạo của rượu etylic là CH3-CH2-OH. Nhóm -OH làm cho rượu etylic có những tính chất hóa học đặc trưng.
3. Rượu etylic có những tính chất hóa học sau: tham gia phản ứng cháy, phản ứng với natri và phản ứng với axit axetic.
4. Rượu etylic là nguyên liêu, nhiên liệu, dung môi.
5. Rượu etylic được điều chế từ tinh bột, đường hoặc etilen.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây