Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Nguyên tử SVIP
I. Quan niệm ban đầu về nguyên tử
- Trước công nguyên, nhà triết học người Hy Lạp Democritus cho rằng "nguyên tử là những hạt rất nhỏ cấu tạo nên chất, không thể phân chia được nữa".
- Đầu thế kỉ XIX, nhà khoa học người Anh Dalton nhận thấy "các đơn vị chất tối thiểu (nguyên tử) kết hợp vừa đủ với nhau theo các lượng xác định trong phản ứng hoá học".
II. Mô hình nguyên tử của Rutherford - Bohr
- Nguyên tử có cấu tạo rỗng.
- Cấu tạo nguyên tử:
- hạt nhân ở tâm mang điện tích dương;
- electron ở lớp vỏ mang điện tích âm;
- electron chuyển động xung quanh hạt nhân như các hành tinh quay quanh Mặt Trời.
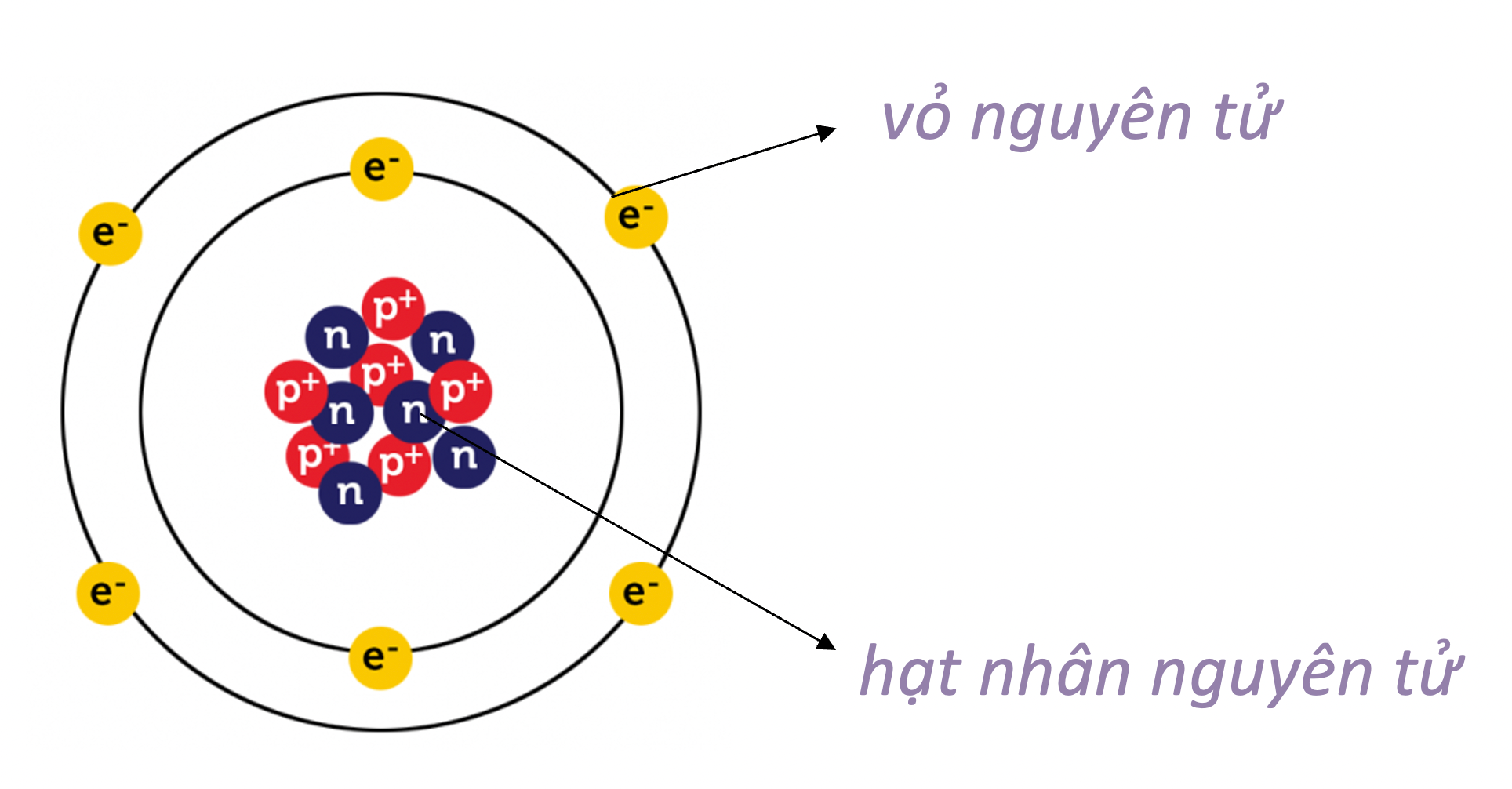
Mô hình hành tinh nguyên tử của Rutherford - Bohr
- Các electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau:
- Lớp trong cùng có 2 electron, bị hạt nhân hút mạnh nhất.
- Các lớp khác chứa tối đa 8 electron hoặc nhiều hơn, bị hạt nhân hút yếu hơn.
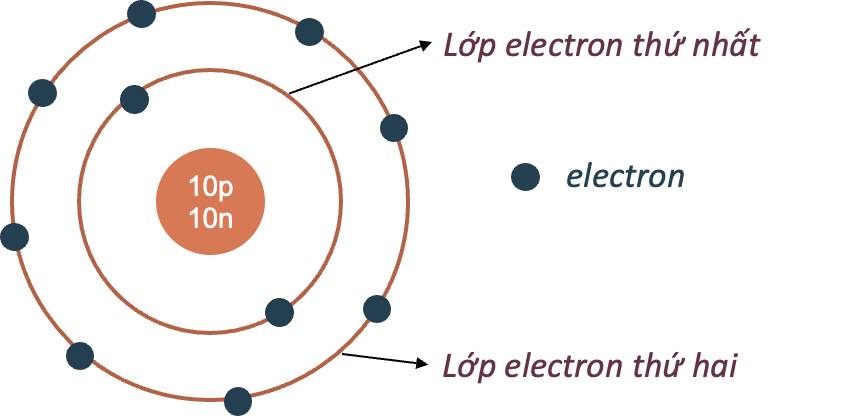
Mô hình nguyên tử Neon
III. Cấu tạo nguyên tử
1. Hạt nhân nguyên tử
- Hạt nhân nằm ở tâm, có kích thước rất nhỏ so với kích thước nguyên tử.
- Hạt nhân nguyên tử được tạo bởi các proton và neutron.
- Proton:
- Kí hiệu: p.
- Mang điện tích dương.
- Giá trị bằng một điện tích nguyên tố (1,602.10-19 culong), viết gọn là +1.
- Neutron:
- Kí hiệu: n.
- Không mang điện tích.
- Số đơn vị điện tích hạt nhân (kí hiệu là Z), bằng tổng số hạt proton có trong hạt nhân.
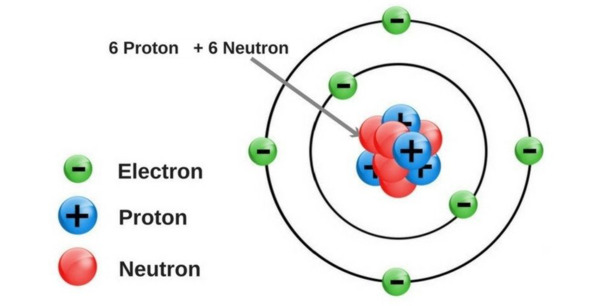
Mô hình nguyên tử carbon
Ví dụ 1: Hạt nhân nguyên tử carbon có 6 proton và 6 neutron.
2. Vỏ nguyên tử
- Vỏ nguyên tử được tạo nên bởi các electron.
- Electron:
- Kí hiệu: e.
- Mang điện tích âm.
- Giá trị điện tích bằng một điện tích nguyên tố (1,602.10-19 culong), viết gọn là -1.
- Các electron được sắp xếp thành từng lớp, lần lượt theo thứ tự từ trong ra ngoài.
- Mỗi lớp có số electron tối đa xác định:
- Lớp thứ nhất có 2 electron.
- Lớp thứ hai có 8 electron.
Ví dụ 2: Vỏ nguyên tử carbon có 6 electron được sắp xếp thành hai lớp, lớp trong cùng có 2 electron, lớp tiếp theo có 4 electron.
IV. Khối lượng nguyên tử
- Khối lượng proton ≃ Khối lượng neutron ≃ 1 amu.
- Khối lượng electron ≃ 0,00055 amu ≪ 1 amu.
- Khối lượng nguyên tử = khối lượng proton + khối lượng neutron + khối lượng electron
≃ khối lượng proton + khối lượng neutron
= khối lượng hạt nhân
1. Nguyên tử là hạt vô cùng nhỏ, trung hoà về điện, cấu tạo nên chất. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm.
2. Hạt nhân nguyên tử gồm các proton mang điện tích dương và neutron không mang điện.
3. Vỏ nguyên tử gồm các hạt electron mang điện tích âm sắp xếp thành từng lớp.
4. Khối lượng nguyên tử tập trung ở hạt nhân, được coi bằng khối lượng hạt nhân và có đơn vị là amu.

Bạn có thể đánh giá bài học này ở đây