cho 1,2g kim loại copper tác dụng với V lít khí oxygen(25 độ C, 1 bar)thu được a gam copper (II) oxide (CuO)
A) LẬP phương trình hóa học của phản ứng?
B)tính a
C) Tính v
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảng tuần hoàn (tên đầy đủ là Bảng tuần hoàn các nguyên tố hóa học, còn được biết với tên Bảng tuần hoàn Mendeleev, là một phương pháp liệt kê các nguyên tố hóa học thành dạng bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng nha

Phản ứng hoá học là Quá trình biến đổi từ chất này thành chất khác
Ví dụ 3: Iron + Sulfur → Iron (II) sulfide
Bạn có thể xem chi tiết tại https://olm.vn/chu-de/phan-ung-hoa-hoc-2189387820


Ta có pt
2Al + 3H2SO4 → Al3(SO4)3+3H2
Pt2 mol 3 mol 1 mol 3 mol
Đb0.2 mol 0.3 mol
Ag không tác dụng vậy mAg là 3 g
Số mol H2 là
nH2=V/22,4 =5,6/22,4= 0,3 ( mol )
Theo pt : nAl = 2/3 nH2 = 2/3 0,3= 0,2 ( mol )
Kl Al là
m Al = M.n = 27 . 0,2 =5,6 ( g )
Kl X là 3+5,6=8,6 (g)
Thành phần phần trăm theo khối lượng của Al là
% Al =m Al/mX .100%= 5,6/8,6.100≈ 65,12 %
Thành phần phần trăm theo khối lượng của Ag là
% Ag= 100% - 65, 12%= 34,88 %

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_{HCl}=0,25.2=0,5\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,2 0,4 0,2 0,2
\(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)=> HCl dư
\(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(C_{M\left(ZnCl_2\right)}=\dfrac{0,2}{0,25}=0,8\left(M\right)\)
\(C_{M\left(HCldu\right)}=\dfrac{0,1}{0,25}=0,4\left(M\right)\)
đktc thì chắc là b học chương trình cũ chứ nhỉ?

a, \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_{2\downarrow}+Na_2SO_4\)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
b, \(m_{CuSO_4}=160.10\%=16\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\)
Theo PT: \(n_{NaOH}=2n_{CuSO_4}=0,2\left(mol\right)\Rightarrow V_{NaOH}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)
c, \(n_{CuO}=n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,1\left(mol\right)\)
\(\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)

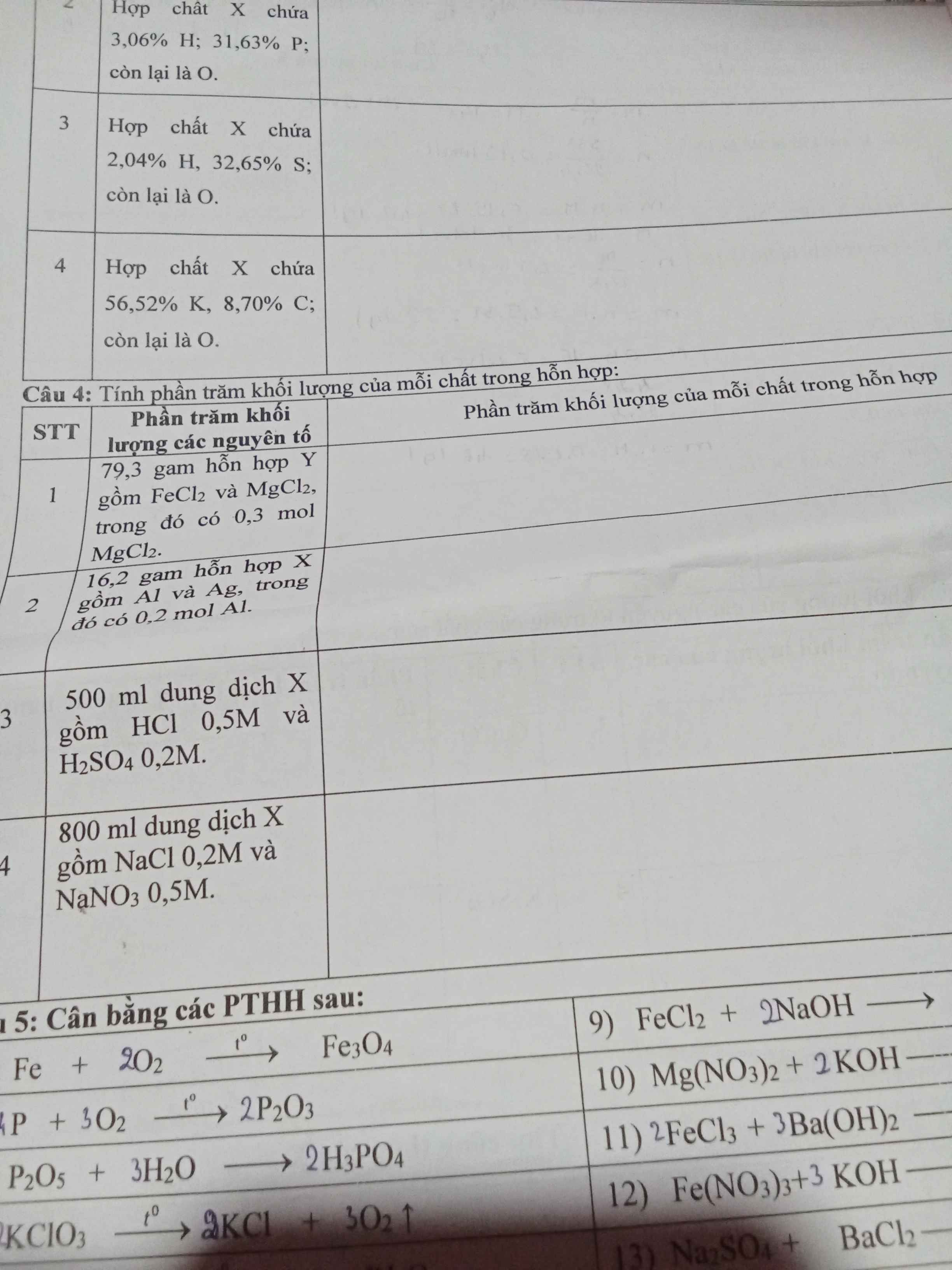
Câu 4:
\(\%m_{MgCl_2}=\dfrac{0,3.95.100\%}{79,3}=35,94\%,\%m_{FeCl_2}=100\%-35,94\%=64,06\%,\)
2) \(\%m_{Al}=\dfrac{0,2.27.100\%}{16,2}=33,33\%\\ \%m_{Ag}=100\%-33,33=66,67\%\)
3) \(n_{HCl}=0,5.0,5=0,25;n_{H_2SO_4}=0,2.0,5=0,1\left(mol\right)\)
\(\%m_{HCl}=\dfrac{0,25.36,5.100\%}{0,25.36,5+0,1.98}=48,22\%\\ \%m_{H_2SO_4}=100\%-48,22\%=51,78\%\)
4)
\(n_{NaCl}=0,2.0,8=0,16\left(mol\right),n_{NaNO_3}=0,5.0,8=0,4\left(mol\right)\Rightarrow\%m_{NaCl}=\dfrac{0,16.58,5.100\%}{0,16.58,5+0,4.85}=21,59\%\Rightarrow\%m_{NaNO_3}=100\%-21,59\%=78,41\%\)

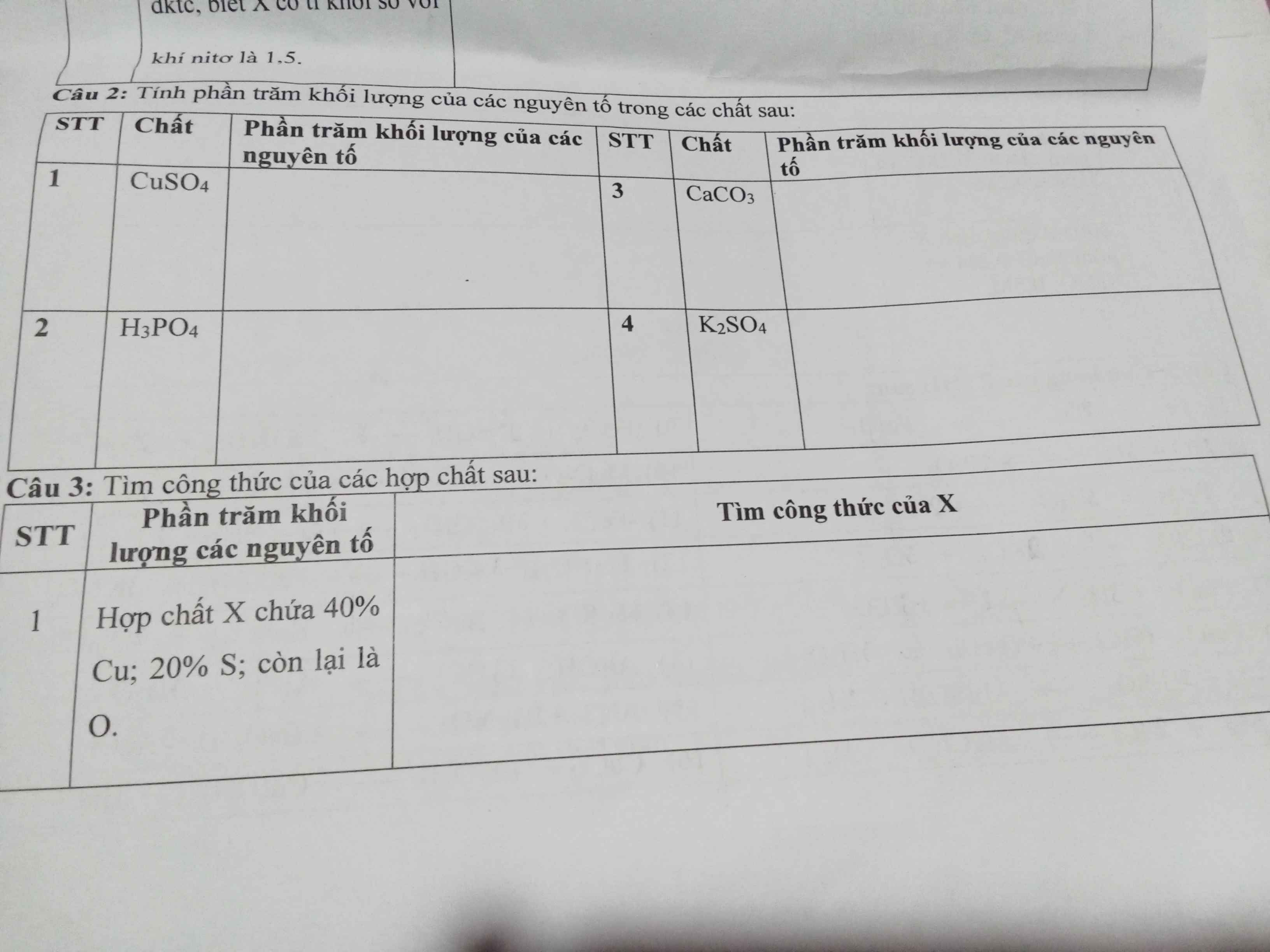
1)
\(\%_{Cu}=\dfrac{64.100\%}{64+96}=40\%,\%_S=\dfrac{32.100\%}{64+96}=20\%,\%_O=100\%-40\%-20\%=40\%\)
2)
\(\%_H=\dfrac{3.100\%}{3+31+16.4}=3,06\%,\%_P=\dfrac{31.100\%}{3+31+16.4}=31,63\%\\ \%_O=100\%-3,06\%-31,63\%=65,31\%\)
3)
\(\%_{Ca}=\dfrac{40.100\%}{100}=40\%,\%_C=\dfrac{12.100\%}{100}=12\%,\%_O=\dfrac{16.100\%}{100}=16\%\text{_}\)
4)
\(\%_K=\dfrac{39.100\%}{39.2+32+16.4}=22,41\%,\%_S=\dfrac{32.100\%}{39.2+32+16.4}=18,39\%\\ \%_O=100\%-22,41\%-18,39\%=59,2\%\)
Câu 3:
Gọi Công thức hóa học của X là: \(Cu_xS_yO_z\)
Ta có:;
\(x:y:z=\dfrac{40}{64}:\dfrac{20}{32}:\dfrac{40}{16}=0,625:0,625:2,5=1:1:4\)
=> CTHC: \(CuSO_4\)



a,pt 2Cu + O2 \(\rightarrow\) 2CuO
b, số mol của Cu:1,2:64=0,01875(mol)
khối lượng của CuO: 0,01875* 80=1,5(g)
c, V lít khí của O2: 0,01875* 24,79=0,4648125(lít)