vì sao khi nhiệt độ tăng thì độ tan SO2 lại giảm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Tính số mol của Zn và Fe.
- Khối lượng mol của Zn = 65,38 g/mol.
- Khối lượng mol của Fe = 55,85 g/mol.
Số mol của Zn: n(Zn) = 0,93 g / 65,38 g/mol ≈ 0,0142 mol.
Số mol của Fe: n(Fe) = 0,93 g / 55,85 g/mol ≈ 0,0166 mol.
- Tính số mol H2SO4 trong dung dịch. Giả sử ta có 100 ml dung dịch H2SO4 9,8%. Khối lượng dung dịch = 100 g (giả định mật độ của dung dịch là 1 g/ml)
Khối lượng H2SO4 trong 100 g dung dịch = 9,8 g.
Số mol H2SO4:
n(H2SO4) = 9,8 g / 98 g/mol ≈ 0,1 mol. - Tính toán phản ứng. Phản ứng giữa Zn và H2SO4:
Zn + H2SO4 → ZnSO4 + H2↑.
Phản ứng giữa Fe và H2SO4: Fe + H2SO4 → FeSO4 + H2↑.
Từ phương trình phản ứng, ta thấy rằng 1 mol Zn và 1 mol Fe cần 1 mol H2SO4. Tổng số mol H2SO4 cần cho cả Zn và Fe là: n(H2SO4 cần) = n(Zn) + n(Fe) = 0,0142 mol + 0,0166 mol = 0,0308 mol.
- So sánh số mol H2SO4 có và cần.
Số mol H2SO4 có trong dung dịch là 0,1 mol, trong khi số mol H2SO4 cần chỉ là 0,0308 mol.
Vậy, số mol H2SO4 còn dư là: n(H2SO4 dư) = n(H2SO4 có) - n(H2SO4 cần) = 0,1 mol - 0,0308 mol = 0,0692 mol.

Ý 1:
\(Đ_r=\dfrac{V_r}{V_r+V_{H_2O}}.100=\dfrac{50}{50+125}.100=28,57\)
Ý 2:
\(\dfrac{25.500:100}{500+V_{nước.thêm\left(ml\right)}}=16\%\\\Leftrightarrow V_{nước.thêm\left(ml\right)}=281,25\left(ml\right)\\ \Rightarrow V_{r\left(sau.pha\right)}=500+281,25=781,25\left(ml\right)\)


`#1194`
Qtr sx thép:
- Nguyên liệu: gang, sắt, thép phế liệu, khí oxygen
- Cách thực hiện:
+ Khí oxy được thổi từ dưới lò lên để đốt cháy tạp chất trong gang
+ Các oxide tạo thành ở dạng khí \(\left(\text{CO}_2;\text{ }\text{ SO}_2;...\right)\) sẽ thoát ra theo khí thải, các oxide dạng rắn \(\left(\text{SiO}_2;\text{ MnO}_2;...\right)\) sẽ tạo ra xỉ nhẹ, nổi lên trên thép nóng.
- Xỉ được tách ra để thu lấy thép.

Lượng nước cần cung cấp cho Hà Nội mỗi ngày là: V H 2 O = 8000000 . 200 = 1600000000 ( l ) = 1600000 ( m 3 ) Lượng clo cần xử lý là: m C l 2 ( C a n x u l y ) = 5 . 160000 = 8000000 ( g ) = 8000 k g

1) MgCL2 + 2KOH ==> Mg(OH)2 + 2KCl
2) Cu(OH)2 + 2HCl ==> CuCl2 + 2H2O
3) CuSO4 + H2SO4 ==> CuSO4 + 2H2O
4) FeO + 2HCl ==> FeCL2 + H2O
5) Fe2O3 + 3H2SO4 ==> Fe2(SO4)3 + 3H2O
6) Cu(NO3)2 + 2NaOH ==> Cu(OH)2 + 2NaNO3
7) 4P + 5O2 ==> 2P2O5
8) N2 + O2 ==> 2NO
9) 2NO + O2 ==> 2NO2
10) 4NO2 + 3O2 + 2H2O ==> 4HNO3

Phương trình phản ứng giữa etilen (C2H4) và brom (Br2) là: C2H4 + Br2 → C2H4Br2 Số mol brom ban đầu: n(Br2) = V(Br2) * M(Br2) = 0.2 L * 1 mol/L = 0.2 mol Theo phương trình phản ứng, tỉ lệ mol giữa C2H4 và Br2 là 1:1. Vì màu nâu đỏ của brom biến mất hoàn toàn, điều đó có nghĩa là brom đã phản ứng hết. Do đó, số mol C2H4 phản ứng bằng số mol Br2 phản ứng: n(C2H4) = n(Br2) = 0.2 mol Thể tích khí C2H4 (ở điều kiện chuẩn, đkc, tức 25°C và 1 atm) được tính như sau: V(C2H4) = n(C2H4) * 24.79 L/mol (24.79 L/mol là thể tích mol của khí ở đkc) V(C2H4) = 0.2 mol * 24.79 L/mol = 4.958 L Vậy thể tích khí C2H4 tham gia phản ứng là xấp xỉ **4.96 lít**.


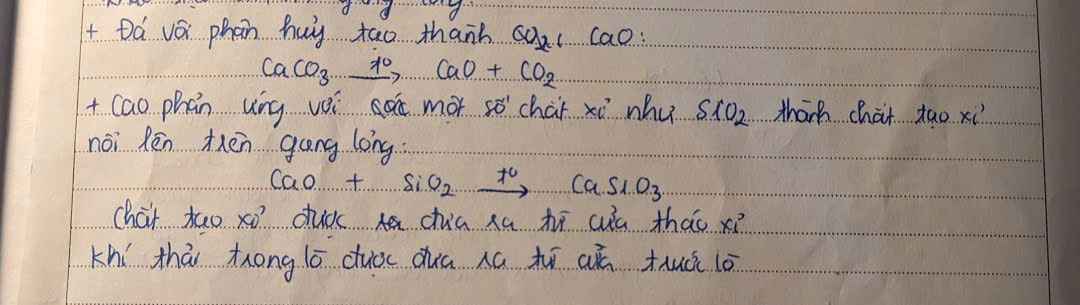
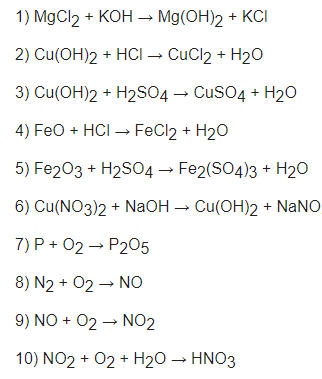
Khi nhiệt độ tăng, độ tan của SO₂ (lưu huỳnh điôxít) trong nước giảm vì nguyên lý nhiệt động học và tính chất của quá trình hòa tan của khí trong dung môi.
Để hiểu rõ hơn, ta cần xem xét các yếu tố sau:
1. Quá trình hòa tan khí trong nước
Khi một khí như SO₂ hòa tan vào nước, quá trình này có thể được mô tả như một quá trình hấp thụ nhiệt. Khi SO₂ tan vào nước, nó sẽ phản ứng với nước và tạo ra các hợp chất như axit sulfuric (H₂SO₄) và axit hyposulfuric (H₂S₂O₃):
\(S O_{2} + H_{2} O \rightleftharpoons H_{2} S O_{3}\)
Quá trình hòa tan khí vào dung môi (như nước) thường mang tính hấp thụ nhiệt, tức là quá trình này cần nhiệt lượng để tiếp diễn.
2. Ảnh hưởng của nhiệt độ
3. Theo lý thuyết Le Chatelier
Theo nguyên lý Le Chatelier, khi nhiệt độ của một hệ tăng lên, hệ sẽ điều chỉnh để giảm bớt sự thay đổi đó. Nếu quá trình hòa tan của SO₂ vào nước là quá trình hấp thụ nhiệt, hệ sẽ phản ứng bằng cách giải phóng khí để làm giảm tác động của nhiệt độ cao, dẫn đến việc giảm độ tan của SO₂.
4. Tính chất khí
SO₂ là một khí có khả năng tan vào nước, nhưng độ hòa tan của khí trong dung môi (như nước) thường giảm khi nhiệt độ tăng. Điều này là do tính chất của khí nói chung: hầu hết các khí đều ít tan hơn trong nước khi nhiệt độ cao.
Kết luận
Vì vậy, khi nhiệt độ tăng, độ tan của SO₂ trong nước giảm do quá trình hòa tan khí vào dung môi là một quá trình hấp thụ nhiệt, và khi nhiệt độ tăng, khí sẽ dễ dàng rời khỏi dung dịch hơn là hòa tan vào trong đó.