Bài 1: Cho sơ đồ phương trình hóa học: Al + HCl ---> AlCl3 + H2.
Hòa tan 5,4 gam Al trong 100ml dung dịch HCl. Tính:
a/ Khối lượng AlCl3 tạo thành.
b/ Nồng độ mol của dung dịch HCl đã dùng
c/ Thể tích khí H2 (ở đkc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chất X có 1 nguyên tử Cl nên X có công thức là \(Na_xCl\left(y=1\right)\)
Khối lượng phân tử chất X :
\(M=\dfrac{m}{n}=29,\dfrac{25}{0,5}=58,5\left(đvc\right)\)
mà \(M=23.x+35,5\)
\(\Rightarrow x=\dfrac{58,5-35,5}{23}=1\)
Vậy CTHH của X là NaCl

Ui hệ số trước \(H_2O\) là \(\dfrac{6-x}{2}H_2O\) mới đúng nha mik ghi nhầm í

\(m_{dd.muối.X}=3,2+196,8=200\left(g\right)\)
Có: \(C\%_X=\dfrac{m_X.100\%}{200}=4\%\Leftrightarrow m_X=8\left(g\right)\) \(M_2\left(SO_4\right)_n\)
\(3,2\left(g\right)M_2O_n\rightarrow8\left(g\right)M_2\left(SO_4\right)_n\)
=> \(n_{SO_4^{2-}}=\dfrac{8-3,2}{96-16}=0,06\left(mol\right)\)
\(C\%_{H_2SO_4}=\dfrac{0,06.98.100\%}{196,8}=2,99\%\)

a)
\(Na_2O+H_2O\rightarrow2NaOH\)
Nhúng giấy quý tím vào dung dịch thấy quỳ chuyển màu xanh.
b)
\(K_2O+H_2O\rightarrow2KOH\)
\(Al_2O_3+2KOH\rightarrow2KAlO_2+H_2O\)
Chất rắn tan dần tạo dung dịch trong suốt.
c)
\(SO_2+2H_2O+Br_2\rightarrow H_2SO_4+2HBr\)
Dung dịch brom bị mất màu.
d)
\(FeO+2HCl\rightarrow FeCl_2+H_2O\)
Chất rắn tan tạo dung dịch màu lục nhạt.

Gọi CTHH của acidic oxide đó là \(X_2O_n\)
\(\%m_X=100\%-56,34\%=43,66\%\)
Ta có : \(\dfrac{x}{2}=\dfrac{M_X}{\%m_X}:\dfrac{M_O}{\%m_O}\)
\(\Rightarrow\dfrac{x}{2}=\dfrac{M_X}{43,66\%}:\dfrac{16}{56,34\%}\)
\(\Rightarrow M_X=6,2n\)
Ta có bảng :
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| \(M_X\) | 6,2 | 12,4 | 18,6 | 24,8 | 31 | 37,2 | 43,4 |
| Kết luận | Loại | Loại | Loại | Loại | P (thỏa mãn) | Loại | Loại |
Vậy \(X\) là \(P\) , A là \(P_2O_5\)

Gọi kim loại đó là \(X\) có hóa trị là n
\(4X+nO_2\underrightarrow{t^o}2X_2O_n\) (1)
\(X_2O_n+2nHCl\rightarrow2XCl_n+nH_2O\) (2)
Ta có : \(n_{X_2O_n}=\dfrac{71,4}{2M_X+16n}\left(mol\right)\)
Theo phương trình (2) \(\Rightarrow n_{XCl_n}=2n_{X_2O_n}=\dfrac{71,4}{M_X+8n}\left(mol\right)\)
\(\Rightarrow m_{XCl_n}=\dfrac{71,4}{M_X+8n}.\left(M_X+35,5n\right)=186,9\)
\(\Rightarrow\dfrac{71,4M_X+2534,7n}{M_X+8n}=186,9\)
\(\Rightarrow71,4M_X+2534,7n=186,9M_X+1495,2n\)
\(\Rightarrow115,5M_X=1039,5n\)
\(\Rightarrow M_X=9n\)
Ta có bảng :
| n | 1 | 2 | \(\dfrac{8}{3}\) | 3 |
| \(M_X\) | 9 | 18 | 24 | 27 |
| Kết luận | Loại | Loại | Loại | Al (thỏa mãn) |
Vậy X là nhôm ( Al )
Ta có : \(n_{Al_2O_3}=\dfrac{71,4}{102}=0,7\left(mol\right)\)
Theo phương trình (1) \(\Rightarrow n_{Al}=2n_{Al_2O_3}=0,7.2=1,4\left(mol\right)\)
\(\Rightarrow m=m_{Al}=1,4.27=37,8\left(g\right)\)

Từ công thức tinh thể => M có hóa trị II.
a)
Theo đề có:
\(\%_S=\dfrac{32.100\%}{M+96+18n}=14,95\%\)
\(\%_M=\dfrac{M.100\%}{M+96+18n}=29,91\%\)
=> Với `n=3` thì `M=64(Cu)`
=> Công thức tinh thể: \(CuSO_4.3H_2O\)
b)
\(m_{CuSO_4}=\dfrac{85,6}{214}.160=64\left(g\right)\)

\(n_{co_2}=\dfrac{0,896}{22,4}=0,02\left(mol\right)\)
\(n_{BaCl_2}=\dfrac{100.20,8\%}{208}=0,1\left(mol\right)\)
PTHH :
\(BaCl_2+Na_2CO_3\rightarrow BaCO_3+2NaCl\) (1)
Như vậy : dung dịch X gồm \(BaCO_3;NaCl;\) có thể có \(BaCl_2\) dư hoặc \(Na_2CO_3\) dư
PTHH :
\(BaCO_3+H_2SO_4\rightarrow BaSO_4+CO_2+H_2O\) (2)
ctc : \(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\) (3)
+) TH1 : Nếu \(BaCl_2\) dư ( không có phản ứng (3) )
Theo phương trình (2) \(\Rightarrow n_{BaCO_3}=n_{CO_2}=0,04\left(mol\right)\)
Theo phương trình (1) \(\Rightarrow n_{Na_2CO_3}=n_{BaCO_3}=0,04\left(mol\right)\)
\(\Rightarrow m_{Na_2CO_3}=0,04.106=4,24\left(g\right)\)
\(\Rightarrow C_{\%ddNa_2CO_3}=\dfrac{4,24.100\%}{100}=4,24\%\)
BTKL \(\Rightarrow m_{ddBaCl_2}+m_{ddNa_2CO_3}+m_{ddH_2SO_4}=m_{ddspứ}+m_{CO_2}\)
\(\Rightarrow m_{ddBaCl_2}+m_{ddNa_2CO_3}+m_{ddH_2SO_4}-m_{CO_2}=m_{ddspứ}\)
\(\Rightarrow m_{ddspứ}=100+100+100-0,04.44=298,14\left(g\right)\)
+) TH2 : Nếu \(Na_2CO_3\) dư ( xảy ra phản ứng (3) )
Theo phương trình (1) \(\Rightarrow n_{BaCO_3}=n_{BaCl_2}=0,1\left(mol\right)\)
Theo phương trình (2) \(\Rightarrow n_{CO_2\left(2\right)}=n_{BaCO_3\left(1\right)}=0,1\left(mol\right)>0,04\left(mol\right)\) ( vô lí )
\(\Rightarrow\) TH2 loại

- Nguyên tử khối của Nitơ là khoảng 14 amu. ( 14g/mol )
- Nguyên tử khối của Helium là khoảng 4 amu. ( 4g/mol )
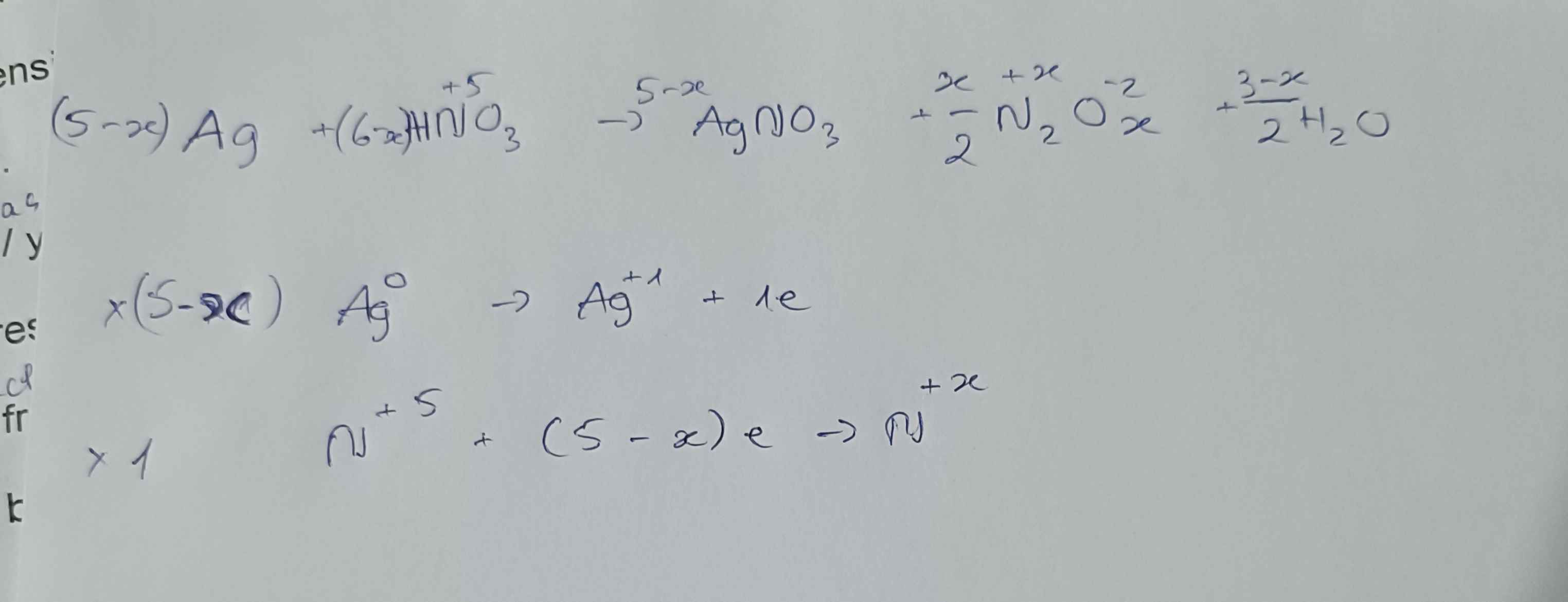
a:
\(n_{Al}=\dfrac{5.4}{27}=0,2\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,2 0,6 0,2 0,3
\(m_{AlCl_3}=0,2\left(27+35,5\cdot3\right)=26,7\left(g\right)\)
b: \(100ml=0,1\left(lít\right)\)
\(C_{M\left(HCl\right)}=\dfrac{0.6}{1}=0,6\left(\dfrac{mol}{lít}\right)\)
c: \(n_{H_2}=3\cdot\dfrac{0.2}{2}=0,3\left(mol\right)\)
=>\(V_{H_2}=0,3\cdot22,4=6,72\left(lít\right)\)