Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Tính chất chung của kim loại SVIP
I. Tính chất vật lí của kim loại
1. Tính dẻo
- Kim loại có tính dẻo nên có thể rèn, kéo dài thành sợi hoặc dát mỏng.

|

|
2. Tính dẫn diện
Thí nghiệm về tính dẫn điện của kim loại
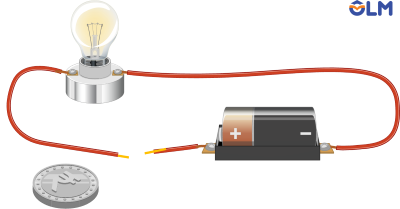

- Kim loại có khả năng dẫn điện, các kim loại khác nhau có khả năng dẫn điện khác nhau. Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Au, Al,...
3. Tính dẫn nhiệt
Thí nghiệm tính dẫn nhiệt của kim loại
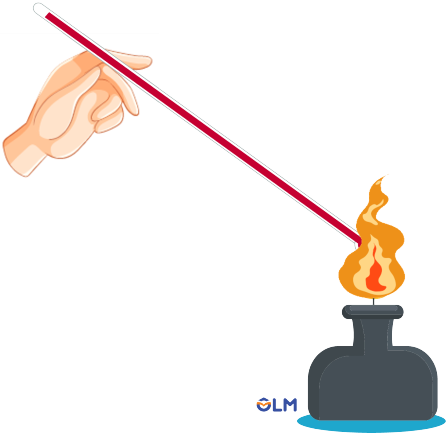
- Kim loại có khả năng dẫn nhiệt. Các kim loại dẫn điện tốt thường cũng dẫn điện tốt.
4. Tính ánh kim
Khi quan sát các đồ trang sức bằng vàng bạc, ta thấy trên bề mặt của chúng có vẻ sáng lấp lánh gọi là ánh kim.

5. Một số tính chất vật lí khác của kim loại
- Để biết kim loại này nặng hay nhẹ hơn so với kim loại khác, người ta thường so sánh giá trị khối lượng riêng của chúng.
- Nhiệt độ nóng chảy của một kim loại là nhiệt độ mà tại đó kim loại chuyển từ thể rắn sang thể lỏng.
- Các kim loại khác nhau thì có tính cứng khác nhau.
II. Tính chất hóa học
1. Phản ứng của kim loại với phi kim
- Tác dụng với oxygen
Hầu hết các kim loại như Ca, Mg, Al, Zn, Fe, Cu,... phản ứng với oxygen tạo thành oxide kim loại.
Ví dụ 1: magnesium (Mg) tác dụng với oxygen (O2) tạo thành magnesium oxide (MgO)
2Mg + O2 \(\underrightarrow{t^o}\) 2MgO
- Tác dụng với phi kim khác
Kim loại có thể tác dụng với nhiều phi kim khác tạo thành muối.
Ví dụ 2: sắt tác dụng với khí chlorine
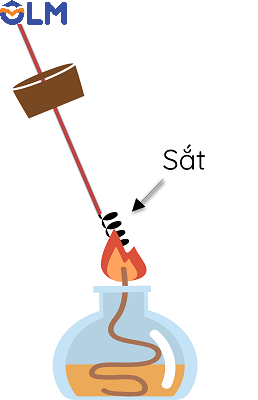
|
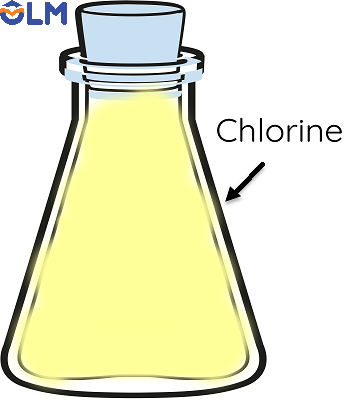
|

|
2. Phản ứng của kim loại với dung dịch acid
- Một số kim loại phản ứng với dung dịch hydrochloric acid tạo thành muối và giải phóng khí hydrogen.
Ví dụ 3: Al + 3HCl ➜ AlCl3 + \(\dfrac{3}{2}\) H2
- Các kim loại Cu, Ag, Au,... không tác dụng với dung dịch HCl.
3. Phản ứng của kim loại với dung dịch muối
- Các kim loại hoạt động mạnh hơn (trừ K, Ca, Na,...) có thể đẩy được kim loại ở mức độ hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
Ví dụ 4: Fe + CuSO4 ➜ FeSO4 + Cu
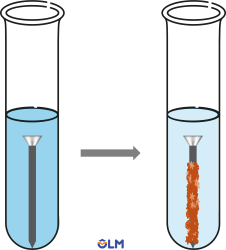
4. Phản ứng với nước
- Một số kim loại như K, Na, Ca,... tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen, tỏa nhiều nhiệt.
Ví dụ 5: 2Na + 2H2O ➜ 2NaOH + H2
- Một số kim loại như Zn, Fe,... tác dụng với hơi nước ở nhiệt độ cao tạo thành oxide và khí hydrogen.
III. Sự khác biệt về tính chất của một số kim loại
- Nhôm là kim loại có màu trắng bạc, khá mềm, dẫn điện, dẫn nhiệt tốt và nhẹ. Nhôm tác dụng được với nhiều phi kim, dung dịch acid và muối,... Tuy nhiên, nhôm bền trong không khí và nước do có lớp màng oxide bảo vệ. Nhôm thường được sử dụng làm dây dẫn diện, nguyên liệu sản xuất khung cửa, vách ngăn,...
- Sắt có màu trắng hơi xám, có tính dẻo, độ cứng cao và có tính nhiễm từ. Sắt tác dụng được với nhiều phi kim, dung dịch acid, muối và hơi nước ở nhiệt độ cao. Sắt có nhiều ứng dụng trong đời sống và sản xuất, là thành phần chủ yếu của gang và thép.
- Vàng là kim loại có tính dẻo, tính dẫn điện, dẫn nhiệt rất tốt, có màu vàng lấp lánh. Vàng bền trong không khí, không bị hòa tan trong dung dịch HCl, H2SO4,... Vàng thường được sử dụng làm đồ trang sức, một số chi tiết của mạch điện tử,...
1. Kim loại có tính dẻo, dẫn điện, dẫn nhiệt, ánh kim và một số tính chất vật lí khác.
2. Nhiều kim loại tác dụng với oxygen tạo thành oxide và tác dụng với các phi kim khác tạo thành muối.
3. Một số kim loại (trừ Cu, Ag, Au,...) tác dụng với dung dịch acid (HCl, H2SO4 loãng,...) tạo thành muối và giải phóng khí H2.
4. Kim loại hoạt động hóa học mạnh hơn (trừ kim loại phản ứng được với nước như K, Na, Ca,...)có thể đẩy kim loại hoạt động hóa học yếu hơn ra khỏi dung dịch muối tạo thành muối mới và kim loại mới.
5. Một số kim loại tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí H2; một số kim loại khác tác dụng được với hơi nước ở nhiệt độ cao tạo thành oxide và khí H2.
6. Một số kim loại quen thuộc trong đời sống như nhôm, sắt, vàng có sự khác biệt về tính chất vật lí, tính chất hóa học. Do vậy, chúng được sử dụng với các mục đích khác nhau trong cuộc sống.

Bạn có thể đánh giá bài học này ở đây