Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Sơ lược về phức chất SVIP
I. Một số khái niệm cơ bản về phức chất
- Phức chất là hợp chất có chứa nguyên tử trung tâm (thường kí hiệu là M) và các phổi tử (thường được kí hiệu là L). Trong đó, nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại liên kết với các phối tử. Phối tử là anion hoặc phân tử. Phức chất có thể mang điện tích hoặc không mang điện tích.
- Trong công thức phức chất, nguyên tử trung tâm M và các phối tử L thường được đặt trong móc vuông.
Ví dụ:
+ Phức chất [Co(NH3)6]3+ có điện tích là +3, nguyên tử trung tâm là Co3+ và phối tử là NH3.
+ Phức chất [Zn(OH)4]2- có điện tích là -2, nguyên tử trung tâm là Zn2+ và phối tử là OH-.
+ Phức chất [Fe(CO)5] không mang điện tích, nguyên tử trung tâm là Fe và phối tử là CO.
II. Một số dạng hình học của phức chất
Trong phức chất [MLn] (điện tích đã được lược bỏ), các phối tử L sắp xếp một cách xác định xung quanh nguyên tử trung tâm M tạo ra các dạng hình học khác nhau, phổ biến là dạng tứ diện, vuông phẳng và bát diện.
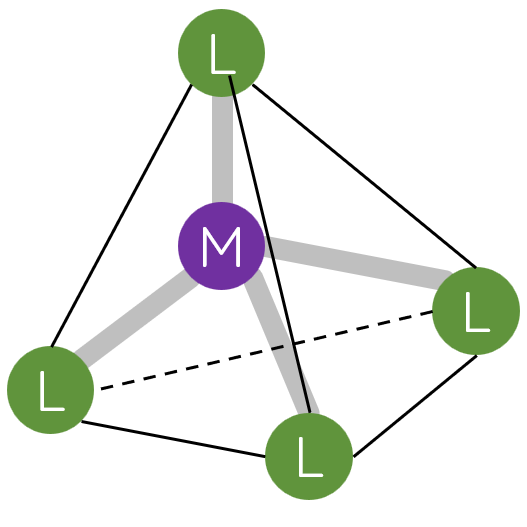
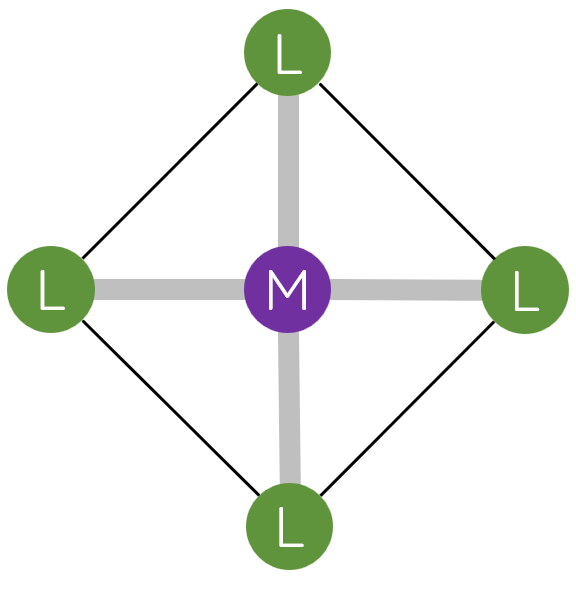
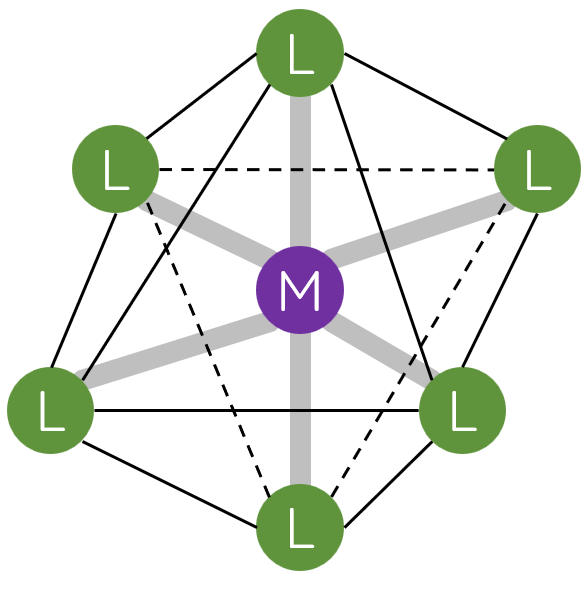
III. Liên kết trong phức chất
1. Liên kết giữa nguyên tử trung tâm và phối tử
- Liên kết hóa học giữa nguyên tử trung tâm M và phối tử L trong phức chất là liên kết cho – nhận, được hình thành nhờ sự cho nhận cặp electron chưa liên kết của phối tử vào orbital trống của nguyên tử trung tâm.
Ví dụ:
+ Liên kết trong phức chất [Co(NH3)6]3+ được hình thành do phối tử NH3 cho cặp electron chứa liên kết vào AO trống của nguyên tử trung tâm Co3+.
+ Liên kết trong phức chất [Zn(OH)4]2- được hình thành do phối tử OH- cho cặp electron chứa liên kết vào AO chưa liên kết vào AO trống của nguyên tử trung tâm Zn2+.
2. Sự hình thành phức chất aqua của một số ion kim loại chuyển tiếp
- Trong dung dịch, các ion kim loại chuyển tiếp Mn+ thường nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hóa trị kiểu cho – nhận, hình thành phức chất qua.
- Hầu hết phức chất aqua có dạng hình học bát diện ([M(H2O)6]n+), chẳng hạn: [Fe(H2O)62+, [Co(H2O)6]3+,...
Ví dụ: Muối CuSO4 khan màu trắng khi tan trong nước tạo thành dung dịch có màu xanh vì tạo thành phức chất [Cu(H2O)6]2+.

|

|
1. Phức chất là hợp chất có chứa nguyên tử trung tâm và các phối tử, nó có thể mang điện tích hoặc không mang điện tích.
2. Các phối tử sắp xếp một cách xác định xung quanh nguyên tử trung tâm, tạo ra các dạng hình học khác nhau, phổ biến là tứ diện, vuông phẳng và bát diện.
3. Phối tử liên kết với nguyên tử trung tâm bằng liên kết cho – nhận.
4. Trong dung dịch, các ion ki loại chuyển tiếp Mn+ thường tạo phức chất aqua, hầu hết có dạng hình học bát diện.

Bạn có thể đánh giá bài học này ở đây