Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Phương trình trạng thái khí lí tưởng SVIP
I. MỐI LIÊN HỆ GIỮA THỂ TÍCH VÀ ÁP SUẤT CỦA CHẤT KHÍ
1. Quá trình đẳng nhiệt
Quá trình biến đổi trạng thái của một khối lượng khí xác định khi nhiệt độ giữ không đổi được gọi là quá trình đẳng nhiệt.
2. Định luật Boyle
Khi nhiệt độ của một khối lượng khí xác định giữ không đổi thì áp suất gây ra bởi khí tỉ lệ nghịch với thể tích của nó:
\(pV\) = hằng số
Đồ thị biểu diễn định luật Boyle là một nhánh của đường hypebol.
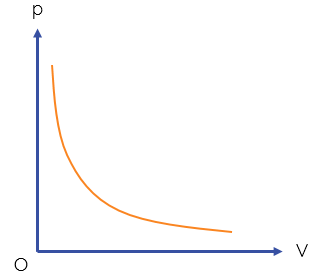
Đường đẳng nhiệt
Đường đẳng nhiệt của cùng một lượng khí ứng với các nhiệt độ khác nhau thì khác nhau. Hình dưới đây vẽ hai đường đẳng nhiệt của cùng một lượng khí ứng với hai nhiệt độ \(T_1\) và \(T_2\) với \(T_1< T_2\).
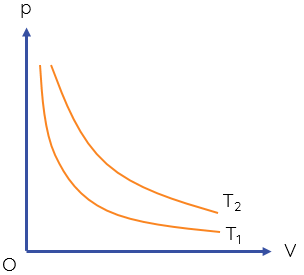
Các đường đẳng nhiệt của cùng một lượng khí ở các nhiệt độ khác nhau
Nếu gọi \(p_1\), \(V_1\) là áp suất và thể tích của khí ở trạng thái 1; \(p_2\), \(V_2\) là áp suất và thể tích của khí ở trạng thái 2 thì:
\(p_1V_1=p_2V_2\)
II. MỐI LIÊN HỆ GIỮA THỂ TÍCH VÀ NHIỆT ĐỘ CỦA CHẤT KHÍ
1. Quá trình đẳng áp
Quá trình biến đổi trạng thái của một khối lượng khí xác định khi giữ áp suất không đổi được gọi là quá trình đẳng áp.
2. Định luật Charles
Khi áp suất của một khối lượng khí xác định giữ không đổi thì thể tích của khí tỉ lệ thuận với nhiệt độ tuyệt đối của nó.
\(\dfrac{V}{T}\) = hằng số
Nếu gọi \(V_1,\) \(T_1\) lần lượt là thể tích và nhiệt độ tuyệt đối ở trạng thái 1; \(V_2,\) \(T_2\) lần lượt là thể tích và nhiệt độ tuyệt đối ở trạng thái 2 thì:
\(\dfrac{V_1}{T_1}=\dfrac{V_2}{T_2}\)
Đồ thị biểu diễn định luật Charles như sau:
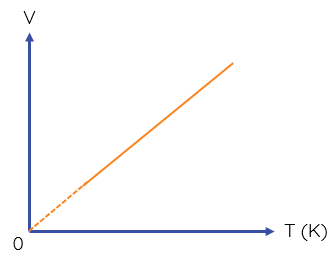
Đường đẳng áp
III. PHƯƠNG TRÌNH TRẠNG THÁI KHÍ LÍ TƯỞNG
1. Phương trình trạng thái của một lượng khí xác định
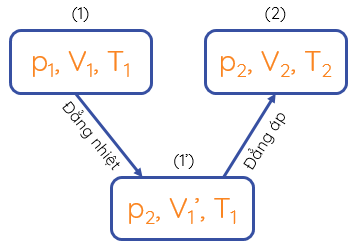
Quá trình chuyển từ trạng thái (1) qua trạng thái trung gian (1') tới trạng thái (2) của một khối lượng khí xác định
Mối liên hệ giữa ba thông số trạng thái của một khối lượng khí xác định:
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Rightarrow\dfrac{pV}{T}\) = hằng số
Phương trình trên được gọi là phương trình trạng thái của một khối khí lí tưởng xác định, thường gọi tắt là phương trình trạng thái của khí lí tưởng.
2. Phương trình Clapeyron
Một mol của bất kì khí nào ở điều kiện tiêu chuẩn đều có thể tích $V$ = 22,4.10-3 m3; áp suất $p$ = 1,013.105 Pa và nhiệt độ $T$ = 273 K.
Phương trình trạng thái của một lượng $n$ mol khí lí tưởng, cũng thường được gọi tắt là phương trình trạng thái của khí lí tưởng:
\(pV=nRT\)
Trong đó $R$ là hằng số khí lí tưởng ($R$ = 8,31 J/mol.K); $n$ là số mol khí:
\(n=\dfrac{m}{M}\)
Với $m$ là khối lượng khí (kg), $M$ là khối lượng mol của lượng khí (kg/mol).
Nhà vật lí Clapeyron người Pháp là người lập ra phương trình này nên nó còn được gọi là phương trình Clapeyron.
❗Lưu ý: Cách đổi một số đơn vị đo áp suất:
1 N/m2 = 1 Pa
1 atm = 1,013.105 Pa
1 mmHg = 133,3 Pa
1 Bar = 105 Pa
1. Định luật Boyle: \(pV\) = hằng số (\(T\) không đổi)
2. Định luật Charles: \(\dfrac{V}{T}\) = hằng số (\(p\) không đổi)
3. Phương trình trạng thái của một lượng khí lí tưởng:
\(pV=nRT\) với \(n\) là số mol khí

Bạn có thể đánh giá bài học này ở đây