Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Phương trình trạng thái của khí lí tưởng SVIP
I. PHƯƠNG TRÌNH TRẠNG THÁI CỦA KHÍ LÍ TƯỞNG
1. Phương trình trạng thái của một lượng khí xác định
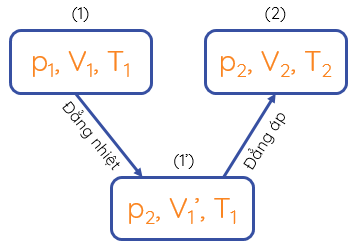
Quá trình chuyển từ trạng thái (1) qua trạng thái trung gian (1') tới trạng thái (2) của một khối lượng khí xác định
Mối liên hệ giữa ba thông số trạng thái của một khối lượng khí xác định:
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Rightarrow\dfrac{pV}{T}\) = hằng số
Phương trình trên được gọi là phương trình trạng thái của một khối khí lí tưởng xác định, thường gọi tắt là phương trình trạng thái của khí lí tưởng.
2. Phương trình Clapeyron
Một mol của bất kì khí nào ở điều kiện tiêu chuẩn đều có thể tích $V$ = 22,4.10-3 m3; áp suất $p$ = 1,013.105 Pa và nhiệt độ $T$ = 273 K.
Phương trình trạng thái của một lượng $n$ mol khí lí tưởng, cũng thường được gọi tắt là phương trình trạng thái của khí lí tưởng:
\(pV=nRT\)
Trong đó $R$ là hằng số khí lí tưởng ($R$ = 8,31 J/mol.K); $n$ là số mol khí:
\(n=\dfrac{m}{M}\)
Với $m$ là khối lượng khí (kg), $M$ là khối lượng mol của lượng khí (kg/mol).
Nhà vật lí Clapeyron người Pháp là người lập ra phương trình này nên nó còn được gọi là phương trình Clapeyron.
❗Lưu ý: Cách đổi một số đơn vị đo áp suất:
1 N/m2 = 1 Pa
1 atm = 1,013.105 Pa
1 mmHg = 133,3 Pa
1 Bar = 105 Pa
II. VẬN DỤNG
Phương trình trạng thái của khí lí tưởng có nhiều ứng dụng thực tế.

- Dùng vào việc nghiên cứu, chế tạo các thiết bị có liên quan đến chất khí như khí cầu, bình đựng khí, trang phục lặn, máy điều hòa không khí, máy nén khí, ...
- Nghiên cứu sự thay đổi áp suất và thể tích của các lớp khí tồn tại trong các vật liệu để tìm tòi, sản xuất các vật liệu đáp ứng được các yêu cầu sử dụng khác nhau.
- Nghiên cứu sự thay đổi áp suất, nhiệt độ, khối lượng riêng của không khí trong khí quyển, tìm hiểu quá trình biến đổi khí hậu để dự báo thời tiết, ...
1. Phương trình trạng thái của khí lí tưởng xác định:
\(\dfrac{pV}{T}\) = hằng số
Độ lớn của hằng số phụ thuộc vào lượng khí mà ta xét.
2. Phương trình trạng thái của khí lí tưởng (phương trình Clapeyron):
\(pV=nRT\)
Trong đó $R$ là hằng số khí lí tưởng ($R$ = 8,31 J/mol.K); $n$ là số mol khí:
\(n=\dfrac{m\left(kg\right)}{M\left(kg/mol\right)}\)

Bạn có thể đánh giá bài học này ở đây