Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lưu ý: Ở điểm dừng, nếu không thấy nút nộp bài, bạn hãy kéo thanh trượt xuống dưới.
Bạn phải xem đến hết Video thì mới được lưu thời gian xem.
Để đảm bảo tốc độ truyền video, OLM lưu trữ video trên youtube. Do vậy phụ huynh tạm thời không chặn youtube để con có thể xem được bài giảng.
Nội dung này là Video có điểm dừng: Xem video kết hợp với trả lời câu hỏi.
Nếu câu hỏi nào bị trả lời sai, bạn sẽ phải trả lời lại dạng bài đó đến khi nào đúng mới qua được điểm dừng.
Bạn không được phép tua video qua một điểm dừng chưa hoàn thành.
Dữ liệu luyện tập chỉ được lưu khi bạn qua mỗi điểm dừng.
Nội dung bài học:
- Số oxi hóa.
- Chất oxi hóa, chất khử, phản ứng oxi hóa – khử.
- Lập PTHH của phản ứng oxi hóa khử.
- Phản ứng oxi hóa khử trong thực tiễn.
Điền số thích hợp vào chỗ trống để hoàn thành phản ứng oxi hóa khử sau:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
Trong các phản ứng dưới đây, phản ứng nào là phản ứng oxi hóa khử:
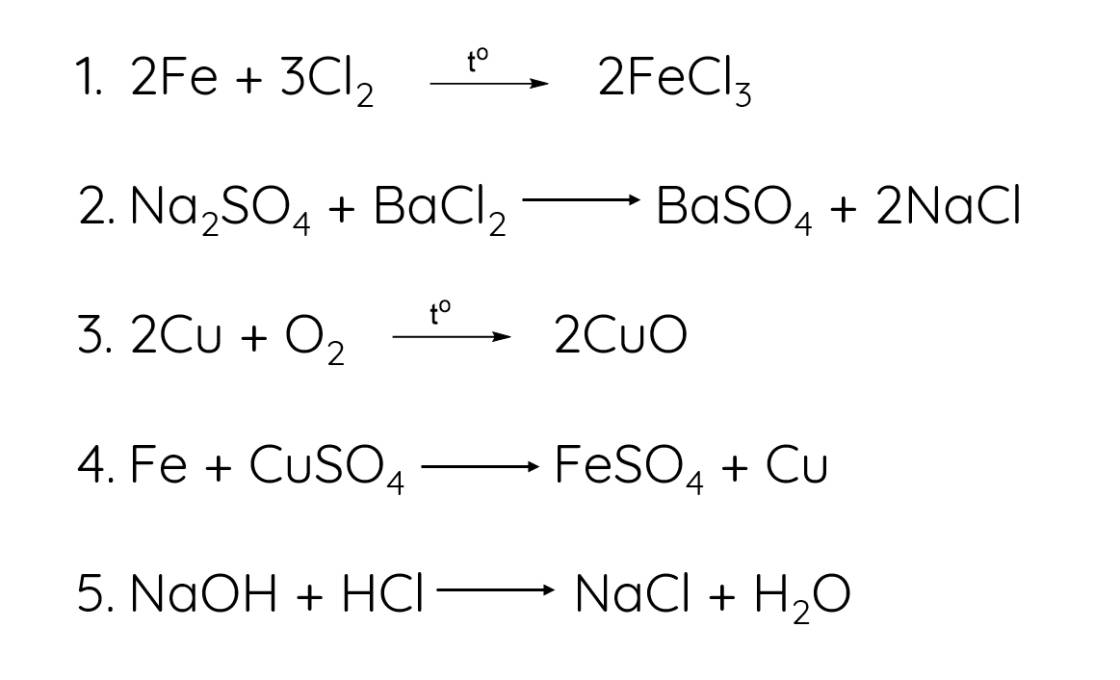
Cho 2 phương trình hóa học sau, hãy xác định chất khử, chất oxi hóa của mỗi phương trình.
a, CH4 + 2O2 ---> CO2 + 2H2O
b, Fe2O3 + 3CO ----> 2Fe + 3CO2
Chất khử của phương trình à là , phương trình b là .
Chất oxi hóa của phương trình a là , phương trình b là .
(Kéo thả hoặc click vào để điền)
Chất khử là chất có số oxi hóa sau phản ứng.
Chất oxi hóa là chất có số oxi hóa sau phản ứng.
(Kéo thả hoặc click vào để điền)
Văn bản dưới đây là được tạo ra tự động từ nhận diện giọng nói trong video nên có thể có lỗi
- Chào mừng các em đã quay trở lại với
- khóa học khóa học 10 của olm.vn hôm nay
- chúng ta sẽ tìm hiểu về phần 2 của bài
- phản ứng oxi hóa khử ở phần trước chúng
- ta đã tìm hiểu về số siêu hóa phần này
- chúng ta sẽ tìm hiểu về chất oxi hóa
- chất khử phản ứng ôxi hóa khử là phương
- trình hóa học của phản ứng oxi hóa khử
- và phản ứng oxi hóa khử trong thực tiễn
- đầu tiên chúng ta cùng đến với một số
- khái niệm chất oxi hóa chất khử cô có ví
- dụ như sau cabin + Oxyz
- của các nguyên tử trong phản ứng đối với
- việc xác định số oxi hóa này các em có
- thể xem video bài giảng trước cô đã giảm
- rất chi tiết khi đó cô thấy ca bần có số
- xuôi hóa trước phản ứng là 0 sau phản
- ứng khi về hợp chất là Dương 4 ốc sên
- chữa phản ứng là không Sau khi về hợp
- chất là -2 như vậy cô kết luận cabin là
- chất khử còn Oxyz
- chất khử chất oxy hóa có sự thay đổi số
- oxy hóa như thế nào trước và sau phản
- ứng
- [âm nhạc]
- câu trả lời của các em rất chính xác
- chúng ta hãy cùng phân tích ví dụ trên ở
- ví dụ này tab ẩn của chúng ta trước phản
- ứng có số oxi hóa là không đã nhường đi
- 4 electron để tạo thành countain dương 4
- tương tự như vậy phân tử Oxyz của chúng
- ta đã nhận 4 electron để tạo thành ion
- oxician - 2 như vậy khi thấy quá trình
- như E của cabin cô gọi đó là quá trình
- oxy hóa còn quá trình E của oction có
- gọi là quá trình khử vậy cô sẽ tổng kết
- như sau chất khử là chất Nhược electron
- chất oxi hóa là chất nhận electron quá
- trình oxy hóa là quá trình Chất khử nhờ
- electron và ngược lại quá trình khử là
- quá trình chất oxi hóa nhận electron
- [âm nhạc]
- [âm nhạc]
- [âm nhạc]
- với phản ứng số 1 số 3 và số 4 có sự
- thay đổi số sinh hóa nhắc lại phần xác
- định số tiêu hóa này cô đã Giảng rất chi
- tiết trong bài phản ứng oxi hóa khử phần
- 1 các em chưa rõ có thể theo dõi lại
- chúng ta đã xác định được phản ứng oxi
- hóa khử vậy lập phương trình hóa học của
- phản ứng ôxi hóa khử chúng ta sẽ dựa vào
- nguyên tắc gì ta cùng đến với mục lập
- phương trình hóa học của phản ứng oxi
- hóa khử đầu tiên với nguyên tắc rất đơn
- giản tổng số electron chất khử nhường sẽ
- bằng tổng số electron chất oxi hóa nhận
- và để làm rõ hơn nguyên tắc này chúng ta
- cùng xét ví dụ lập phương trình hóa học
- sau bằng phương pháp thăng bằng electron
- cô có NH3 + O2 xúc tác và nhiệt độ tạo
- thành NO và H2O nhớ rằng khi kem lập
- phương trình hóa học của phản ứng ôxi
- hóa khử các em phải hoàn thành các hệ số
- sao cho phương trình đó được cân bằng
- bước đầu tiên xác định các nguyên tử có
- sự thay một số suy hóa từ đó xác định
- chất oxy hóa chất khử ở trong phân tử
- Amoniac có natrogen là -3 đã tăng lên
- Dương 2 sau phản ứng trong phân tử Oxyz
- sau phản ứng như vậy Amoniac là chất khử
- còn Oxyz
- Bước 2 chúng ta sẽ biểu diễn quá trình
- oxy hóa quá trình khử ứng với chất khử
- là quá trình oxy hóa còn ứng với chất
- oxi hóa là quá trình khử ta sẽ biểu diễn
- như sau Nat cho dừng là -3 sẽ nhường đi
- 5 electron để thành natuan dương 2 phân
- tử Oxyz
- - 2 sau khi biểu diễn quá trình oxy hóa
- quá trình khử ta đến với bước 3 là tìm
- hệ số thích hợp cho chất khử và chất oxi
- hóa dựa trên nguyên tắc tổng số electron
- chất khử nhường sẽ bằng tổng số electron
- chất oxi hóa nhận
- [âm nhạc]
- vào Cu cộng với HNO3 tạo thành
- cuno32 + no + H2O
- [âm nhạc]
- các em làm rất tốt tương tự như ví dụ
- trên chúng ta cũng xác định số siêu hóa
- của các nguyên tử trong phản ứng như vậy
- cô thấy cu của cô là chất khử còn HNO3
- của cô là chất oxi hóa cụ thể hơn là
- nguyên tử Nitơ có số tiêu hóa là dương 5
- tiếp theo chúng ta sẽ biểu diễn quá
- trình nhường và nhận electron nguyên tử
- cu từ 0 sẽ nhường đi 2 E để tạo thành
- ion cu2+ và ngược lại nguyên tử Nitơ
- dương 5 sẽ nhận 3E để tạo thành nito
- Dương 2 sau đó ta tìm bội chung nhỏ nhất
- của 2 là 3 quá trình oxy hóa chúng ta sẽ
- nhân thêm 3 và quá trình khử chúng ta sẽ
- nhân thêm 2 bước cuối cùng chúng ta sẽ
- điền hệ số vào phương trình oxi hóa khử
- đầu tiên ta thêm 3 và Cu sau đó ta cân
- bằng 3 ở CuNO3 tất cả hai lần tiếp theo
- ta thêm 2 và no sau đó ta sẽ đếm tổng số
- Nitơ ở sau phản ứng và ta sẽ thêm 8 và
- HNO3 ta cân bằng hidro bằng cách thêm 4
- và nước cuối cùng ta sẽ kiểm tra xem
- phân tử o đã được cân bằng chưa Nếu phân
- tử o trước và sau phản ứng bằng nhau thì
- phương trình hóa học của chúng ta đã
- hoàn thành Cuối cùng chúng ta cùng đến
- với phản ứng oxi hóa khử trong thực tiễn
- trong thực tiễn có rất nhiều phản ứng
- oxi hóa khử Ví dụ như sự quang hợp của
- cây xanh phản ứng trong pin điện hay là
- sự cháy một số phản ứng oxi hóa khử quan
- trọng gắn liền với cuộc bệnh như là sự
- trái của than củi sự cháy của xăng dầu
- trong động cơ đốt trong hay các quá
- trình Điện phân các phản ứng xảy ra
- trong pin ác quy một số phản ứng ôxi hóa
- khử là cơ sở của quá trình sản xuất các
- ngành công nghiệp nặng sản xuất hóa chất
- sản xuất phân bón thuốc bảo vệ thực vật
- và thực phẩm phản ứng ôxi hóa khử có rất
- nhiều ứng dụng trong thực tiễn bài học
- ngày hôm nay chúng ta đã học số oxy hóa
- chất oxi hóa chất khử phản ứng ôxi hóa
- khử lập phương trình hóa học của phản
- ứng oxi hóa khử và một số phản ứng oxi
- hóa khử trong thực tiễn các em hãy về
- nhà tìm hiểu thêm cho cô trong thực tế
- có những phản ứng oxy hóa khử nào và bài
- học ngày hôm nay của chúng ta đã kết
- thúc tại đây Cảm ơn các em đã theo dõi
- các em hãy truy cập vào trang web olm.vn
- để luyện tập và tương tác trực tiếp đừng
- quên Ấn theo dõi kênh hoặc trực tuyến
- online trên YouTube Xin chào và hẹn gặp
- lại các trong các video tiếp theo
- [âm nhạc]
Bạn có thể đăng câu hỏi về bài học này ở đây

