Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Phản ứng hoá học SVIP
I. Biến đổi vật lí và biến đổi hoá học
- Biến đổi vật lí là hiện tượng chất có sự biến đổi về trạng thái, kích thước,... nhưng vẫn giữ nguyên là chất ban đầu.
Ví dụ 1: Hoà tan muối ăn vào trong nước.
- Trong các quá trình như hoà tan, đông đặc, nóng chảy,... các chất chỉ chuyển từ trạng thái này sang trạng thái khác, không có sự tạo thành chất mới, đó là biến đổi vật lí.
- Biến đổi hoá học là hiện tượng chất có sự biến đổi tạo ra chất khác.
Ví dụ 2: Quá trình tiêu hoá thức ăn.
- Các quá trình như đốt cháy nhiên liệu, phân huỷ chất, tổng hợp chất,... có sự tạo thành chất mới, đó là biến đổi hoá học.
- Trong cơ thể người và động vật, sự trao đổi chất là một loạt các quá trình sinh hoá, đó là những quá trình phức tạp, bao gồm cả biến đổi vật lí và biến đổi hoá học.
II. Phản ứng hoá học
1. Khái niệm
- Quá trình biến đổi từ chất này thành chất khác được gọi là phản ứng hoá học.
- Chất ban đầu bị điến đổi trong phản ứng được gọi là chất phản ứng hay chất tham gia.
- Chất mới sinh ra được gọi là chất sản phẩm.
- Phản ứng hoá học được biểu diễn bằng phương trình dạng chữ như sau:
Tên các chất phản ứng → Tên các chất sản phẩm
Ví dụ 3: Iron + Sulfur → Iron (II) sulfide
Đọc là: iron tác dụng với sulfur tạo ra iron (II) sulfide.
Trong đó: iron và sulfur là chất phản ứng, iron (II) sulfide là chất sản phẩm.
- Trong quá trình phản ứng, lượng chất phản ứng giảm dần, lượng sản phẩm tăng dần.
- Phản ứng xảy ra hoàn toàn khi có ít nhất một chất phản ứng đã phản ứng hết.
2. Diễn biến phản ứng hoá học
- Trong phản ứng hoá học xảy ra sự phá vỡ các liên kết trong phân tử chất đầu, hình thành các liên kết mới, tạo ra các phân tử mới. Kết quả là chất này biến đổi thành chất khác.
Ví dụ 4: Phản ứng giữa hydrogen và oxygen tạo thành nước được mô tả như sau:
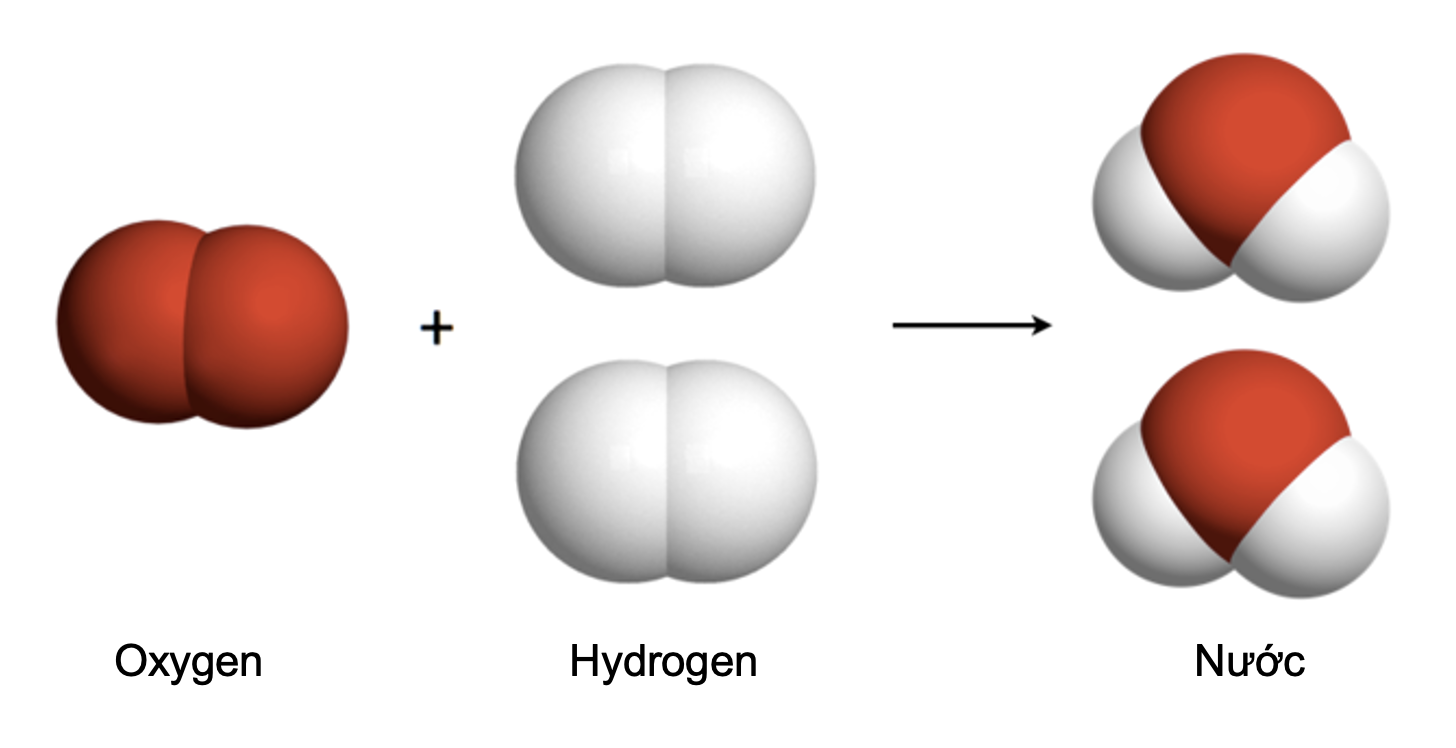
Hình 1: Sơ đồ mô tả phản ứng hoá học giữa hydrogen và oxygen tạo thành nước
3. Hiện tượng kèm theo các phản ứng hoá học
- Phản ứng hoá học xảy ra khi có chất mới được tạo thành với những tính chất mới, khác biệt với chất ban đầu.
- Những dấu hiệu dễ nhận ra có chất mới tạo thành là sự thay đổi về màu sắc, xuất hiện chất khí hoặc xuất hiện chất kết tủa,...
- Sự toả nhiệt và phát sáng cũng là dấu hiệu cho biết phản ứng hoá học đã xảy ra.

Hình 2: Nến cháy kèm theo sự toả nhiệt và phát sáng
III. Năng lượng của phản ứng hoá học
1. Phản ứng toả nhiệt, phản ứng thu nhiệt
- Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt ra môi trường xung quanh.
- Phản ứng thu nhiệt là phản ứng nhận năng lượng dưới dạng nhiệt trong suốt quá trình phản ứng xảy ra.
Ví dụ 5: Đốt đèn cồn, cồn (ethanol) cháy. Khi đó, ethanol và khí oxygen trong không khí tác dụng với nhau tạo thành hơi nước và khí carbon dioxide, đồng thời giải phóng ra năng lượng dưới dạng nhiệt. Phản ứng đốt cháy cồn là phản ứng toả nhiệt.
Ví dụ 6: Phản ứng phân huỷ copper (II) hydroxide thành copper (II) oxide và hơi nước thì cần cung cấp năng lượng dưới dạng nhiệt bằng cách đun nóng. Khi ngừng cung cấp nhiệt, phản ứng dừng lại. Đây là phản ứng thu nhiệt.
2. Ứng dụng của phản ứng toả nhiệt
- Các phản ứng toả nhiệt có vai trò quan trọng trong cuộc sống vì chúng cung cấp năng lượng cho cơ thể sinh hoạt và sản xuất, vận hành động cơ, thiết bị máy công nghiệp, phương tiện giao thông,...
1. Biến đổi hoá học có sự tạo thành chất mới, còn biến đổi vật lí không có sự tạo thành chất mới.
2. Trong phản ứng hoá học, liên kết giữa các nguyên tử thay đổi, làm cho phân tử này biến đổi thành phân tử khác. Kết quả là chất này biến đổi thành chất khác.
3. Để nhận biết phản ứng hoá học xảy ra có thể dựa vào một trong các dấu hiệu sau: sự tạo thành chất khí, chất kết tủa, hay sự thay đổi về màu sắc, sự thay đổi về nhiệt độ của môi trường.
4. Phản ứng toả nhiệt: giải phóng năng lượng (dạng nhiệt) ra môi trường và phản ứng thu nhiệt nhận năng lượng (dạng nhiệt) từ môi trường trong suốt quá trình phản ứng.
5. Các nhiên liệu như than, xăng, dầu,... được sử dụng trong các ngành sản xuất, phục vụ sinh hoạt,...

Bạn có thể đánh giá bài học này ở đây