Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Muối SVIP
I. Khái niệm
- Muối là hợp chất được tạo thành từ sự thành thế ion H+ của acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ 1: Na2SO4 (sodium sulfate), NH4Cl (ammonium chloride).
- Công thức phân tử của muối gồm có cation kim loại và anion gốc acid được gọi tên theo quy tắc sau:
Tên kim loại (hoá trị, đối với kim loại có nhiều hoá trị) + tên gốc acid
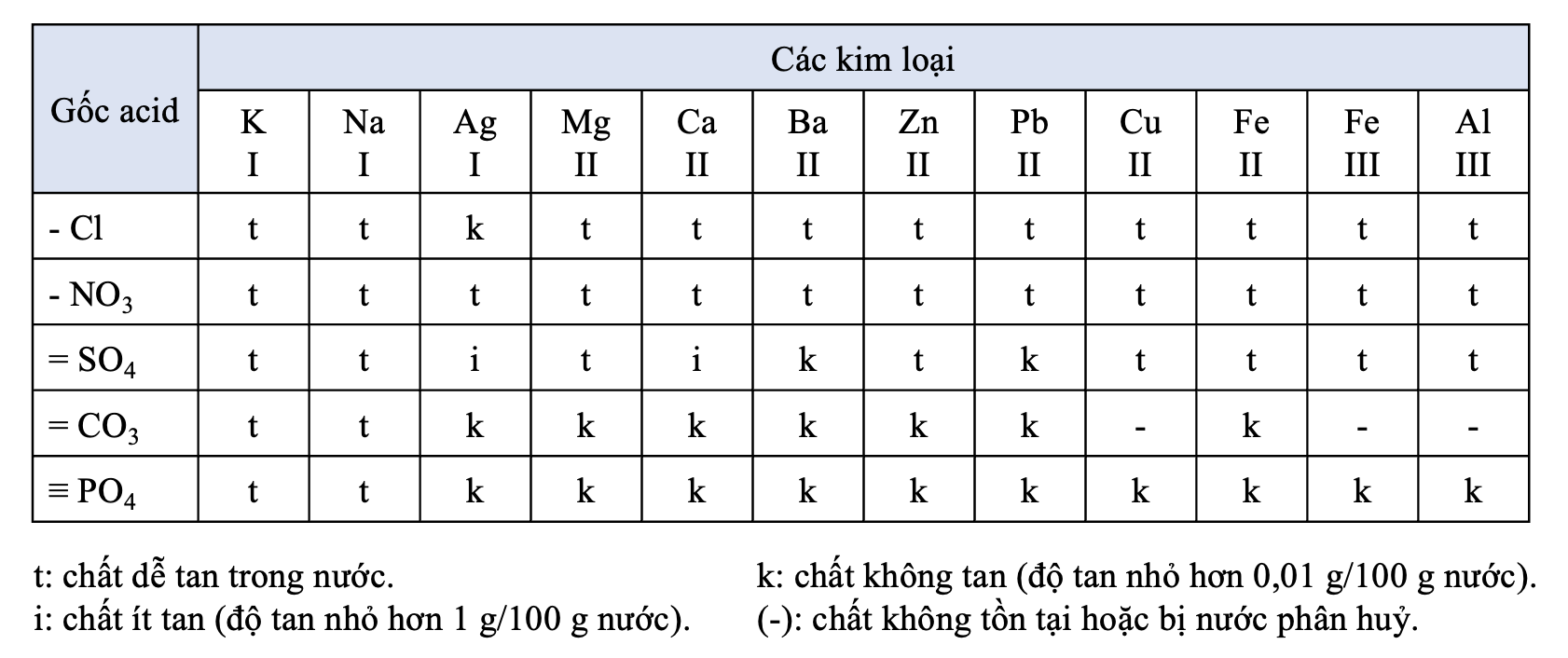
Bảng 1: Tên gọi một số gốc acid
| Gốc acid | Tên gọi | Gốc acid | Tên gọi |
| -Cl | chloride | -CH3COO | acetate |
| -Br | bromide | =S | sulfide |
| -I | iodide | -HS | hydrogensulfide |
| -NO3 | nitrate | =CO3 | carbonate |
| =SO4 | sulfate | -HCO3 | hydrogencarbonate |
| -HSO4 | hydrogensulfate | \(\equiv\)PO4 | phosphate |
| =SO3 | sulfite | =HPO4 | hydrogenphosphate |
II. Tính tan của muối
- Đa số các muối là chất rắn, có những muối không tan trong nước, có muối ít tan, có muối tan tốt trong nước. Người ta đã xây dựng bảng tính tan của các chất để tiện sử dụng.
III. Tính chất hoá học
1. Dung dịch muối tác dụng với kim loại
- Dung dịch muối có thể tác dụng với một số kim loại tạo thành muối mới và kim loại mới.
Ví dụ 2: Zn + FeSO4 → ZnSO4 + Fe
2. Muối tác dụng với dung dịch acid
- Muối có thể tác dụng với một số dung dịch acid tạo thành muối mới và acid mới. Sản phẩm tạo thành của phản ứng có ít nhất một chất là chất khí/chất ít tan/không tan.
Ví dụ 3: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
3. Dung dịch muối tác dụng với dung dịch base
- Dung dịch muối tác dụng với dung dịch base tạo thành muối mới và base mới, trong đó có ít nhất một sản phẩm là chất khí/chất ít tan/không tan,...
Ví dụ 4: FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
4. Dung dịch muối tác dụng với dung dịch muối
- Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới, trong đó có ít nhất một muối không tan hoặc ít tan.
Ví dụ 5: 2AgNO3 + BaCl2 → 2AgCl + Ba(NO3)2
IV. Điều chế
- Muối có thể điều chế bằng một số phương pháp như sau:
+ Dung dịch acid tác dụng với base.
Ví dụ 6: HCl + NaOH → NaCl + H2O
+ Dung dịch acid tác dụng với oxide base.
Ví dụ 7: 2HNO3 + CaO → Cu(NO3)2 + H2O
+ Dung dịch acid tác dụng với muối.
Ví dụ 8: H2SO4 + BaCl2 → BaSO4 + 2HCl
+ Oxide acid tác dụng với dung dịch base.
Ví dụ 9: CO2 + 2NaOH → Na2CO3 + H2O
+ Dung dịch muối tác dụng với dung dịch muối.
Ví dụ 10: NaCl + AgNO3 → AgCl + NaNO3
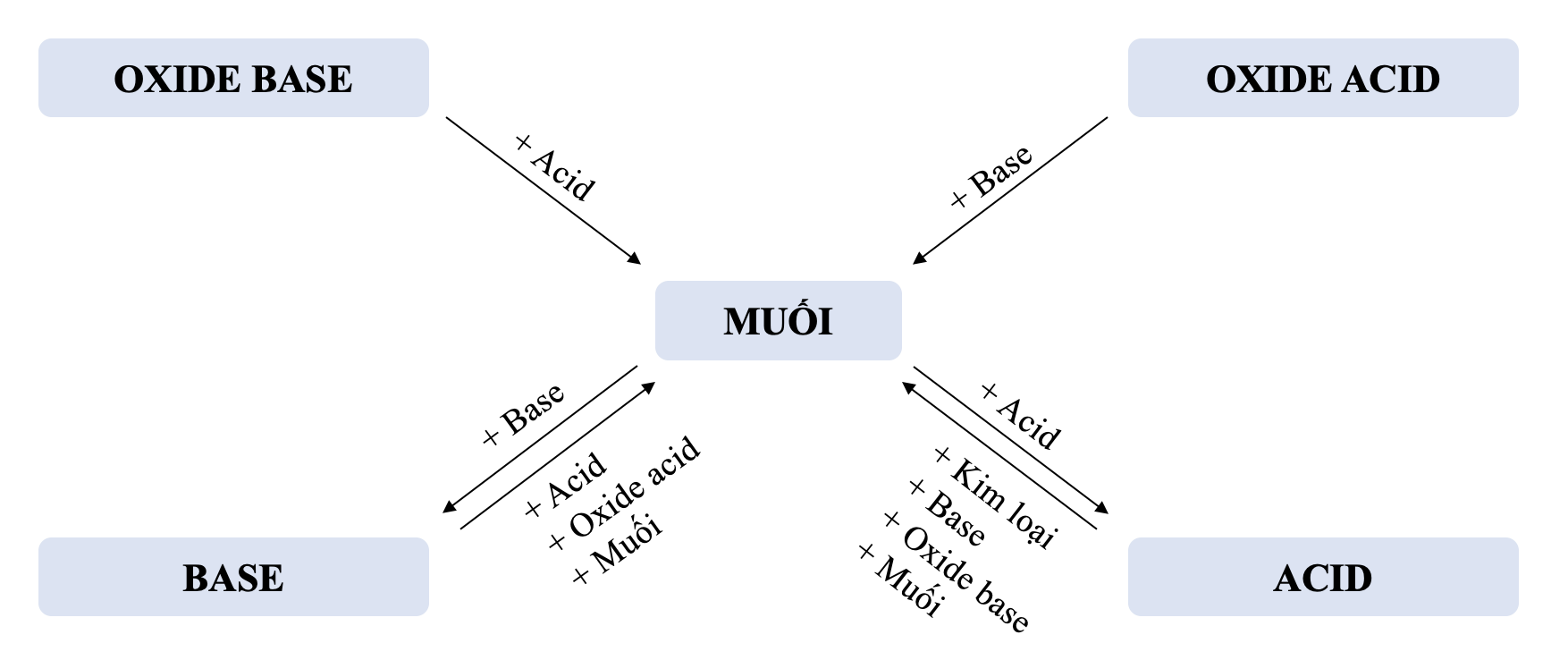
V. Mối quan hệ giữa các hợp chất vô cơ
1. Muối là hợp chất được hình thành từ sự thay thế ion H+ của acid bằng ion kim loại hoặc ion ammonium (NH4+).
2. Các muối có khả năng tan trong nước khác nhau, có muối tan nhiều, có muối tan ít, muối không tan.
3. Tên muối (chứa cation kim loại): tên kim loại (thêm hóa trị nếu kim loại có nhiều hoá trị) + tên gốc acid.
4. Tính chất hoá học của muối: phản ứng với kim loại, acid, muối, base.
5. Các hợp chất vô cơ có thể chuyển đổi hoá học thành các hợp chất vô cơ khác.

Bạn có thể đánh giá bài học này ở đây