Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Một số tính chất và ứng dụng của phức chất SVIP
I. Một số dấu hiệu của phản ứng tạo phức chất và phản ứng thay thế phối tử của phức chất trong dung dịch
1. Một số dấu hiệu của phản ứng tạo phức chất trong dung dịch
- Phản ứng tạo phức chất trong dung dịch có thể được nhận biết dựa vào một số dấu hiệu như:
+ Xuất hiện kết tủa.
Ví dụ: Nhỏ vài giọt dung dịch NaOH vào ống nghiệm chứa dung dịch AlCl3, thấy xuất hiện kết tủa, chứng tỏ phức chất [Al(OH)3(H2O)3] đã được tạo thành.
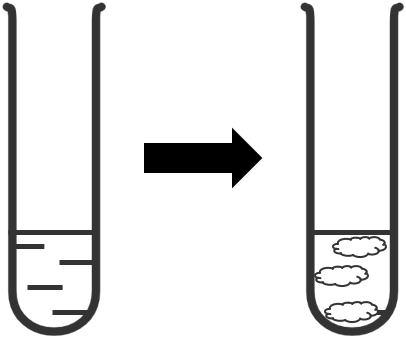
+ Hòa tan kết tủa.
Ví dụ: Nhỏ vài giọt dung dịch NaCl vào ống nghiệm chứa dung dịch AgNO3, thu được kết tủa trắng AgCl. Tiếp tục nhỏ vào ống nghiệm dung dịch NH3 đến dư thấy kết tủa tan, chứng tỏ phức chất [Ag(NH3)2]+ đã được tạo thành.
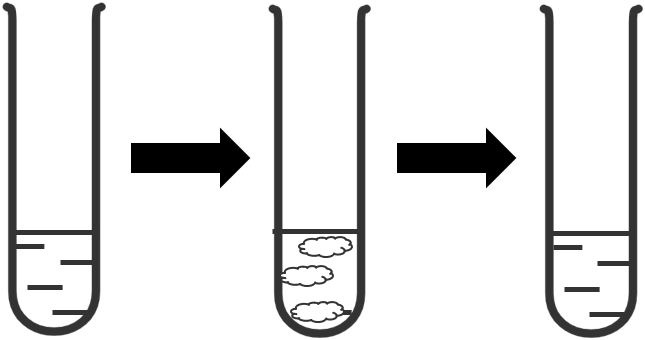
+ Thay đổi màu sắc.
Ví dụ: Nhỏ vài giọt dung dịch HCl đặc vào ống nghiệm chứa dung dịch CuSO4 loãng thấy dung dịch từ màu xanh chuyển sang màu vàng, chứng tỏ phức chất [CuCl4]2- đã được tạo thành.
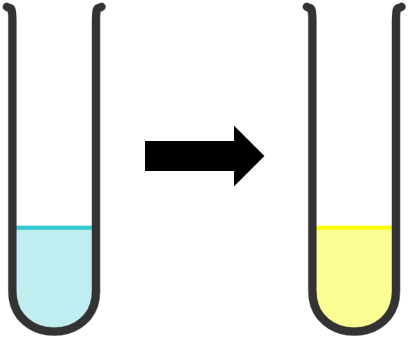
2. Sự tạo thành phức chất của ion kim loại chuyển tiếp và phản ứng thế phối tử của phức chất trong dung dịch
a) Sự tạo thành phức chất của Cu2+ trong dung dịch
Thí nghiệm: Sự tạo thành phức chất của Cu2+
- Chuẩn bị:
+ Hóa chất: Các dung dịch CuSO4 5%, NaOH 10%, NH3 10%, HCl đặc.
+ Dụng cụ: Ống nghiệm.
- Tiến hành:
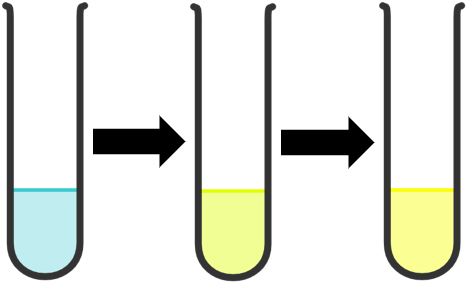
+ Cho khoảng 1 mL dung dịch CuSO4 5% vào ống nghiệm 1. Cho tiếp 3 giọt dung dịch NaOH 10%, lắc đều thấy xuất hiện kết tủa màu xanh là phức [Cu(OH)2(H2O)4]. Nhỏ từ từ dung dịch NH3 10% vào ống nghiệm, vừa nhỏ vừa lắc đều đến khi kết tủa tan hoàn toàn thấy dung dịch có màu xanh lam, phức [Cu(NH3)2(H2O)4]2+ đã được tạo thành.
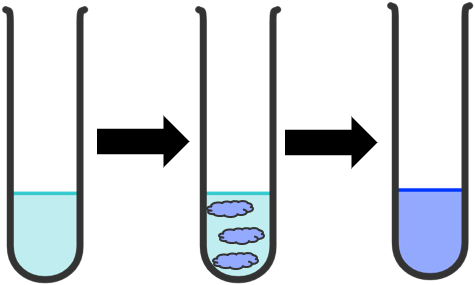
+ Cho khoảng 1 mL dung dịch CuSO4 5% vào ống nghiệm 2. Nhỏ từ từ dung dịch HCl đặc vào ống nghiệm vừa nhỏ vừa lắc đều đến khi dung dịch chuyển màu hoàn toàn, thấy dung dịch từ màu xanh nhạt chuyển dần sang màu lục và cuối cùng là màu vàng, phức [CuCl4]2- đã được tạo thành.
b) Phản ứng thế phối tử của phức chất trong dung dịch
- Phản ứng thế phối tử của phức chất là quá trình xảy ra sự thế phối tử này bởi phối tử khác.
- Phản ứng xảy ra thuận lợi khi phức chất mới được hình thành bền hơn phức chất ban đầu.
Ví dụ:
+ Một phối tử Cl- trong phức chất [PtCl4]2- bị thế bởi một phối tử NH3 tạo ra phức chất [PtCl3(NH3)]-
[PtCl4]-(aq) + NH3(aq) → [PtCl3(NH3)]-(aq) + Cl-(aq)
+ Các phối tử H2O trong phức chất [Fe(H2O)6]2+ bị thế bởi phối tử CN-, tạo ra phức chất [Fe(CN)6]4-.
[Fe(H2O)6]2+(aq) + 6CN-(aq) → [Fe(CN)6]4- + 6H2O(l)
+ Các phối tử H2O trong phức chất [Cu(H2O)6]2+ bị thế bởi phối tử Cl-, tạo ra phức chất [CuCl4]2-.
[Cu(H2O)6]2+(aq) + 4Cl-(aq) → [CuCl4]2-(aq) + 6H2O(l)
II. Một số ứng dụng của phức chất
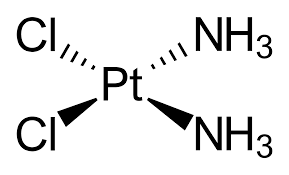
- Trong y học, nhiều phức chất có khả năng chữa trị hoặc kiểm soát bệnh.
Ví dụ: Cisplatin được dùng làm thuốc chữa bệnh ung thư.
- Trong công nghiệp hóa chất, nhiều hợp chất hóa học được điều chế khi có mặt chất xúc tác là phức chất.
Ví dụ: Phản ứng ghép mạch carbon sử dụng xúc tác là phức chất [Pd(P(C6H5)3)4].
![[Pd(P(C6H5)3)4] olm Hóa học 12, [Pd(P(C6H5)3)4], olm](https://cdn3.olm.vn/upload/img_teacher/0705/img_teacher_2024-07-05_66876a0fb7346.jpg)
- Trong hóa học, phức chất được dùng để nhận biết và xác định hàm lượng các ion kim loại chuyển tiếp trong dung dịch.
Ví dụ: Phức chất [Ag(NH3)2]+ để phân biệt aldehyde với ketone.

1. Dấu hiệu của phản ứng tạo thành phức chất trong dung dịch: xuất hiện kết tủa, hòa tan kết tủa, thay đổi màu sắc.
2. Phản ứng thế phối tử trong phức chất.
3. Phức chất có nhiều ứng dụng trong y học, trong công nghiệp tổng hợp hóa chất và trong hóa học.

Bạn có thể đánh giá bài học này ở đây