Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Liên kết ion SVIP
I. Ion và sự tạo thành liên kết ion
- Kim loại điển hình phản ứng rất mạnh với phi kim điển hình tạo ra hợp chất ion. Khi đó, nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation) còn nguyên tử phi kim nhận electron để trở thành ion mang điện tích âm (anion).
Ví dụ 1:
Cấu hình electron của nguyên tử Na (Z = 11): 1s22s22p63s1
→ Có 1 electron ở lớp ngoài cùng (hay có 1 electron hóa trị).
Nguyên tử Na nhường đi 1 electron ở lớp ngoài cùng để tạo thành ion dương Na+ (cation sodium).
Na → Na+ + 1e
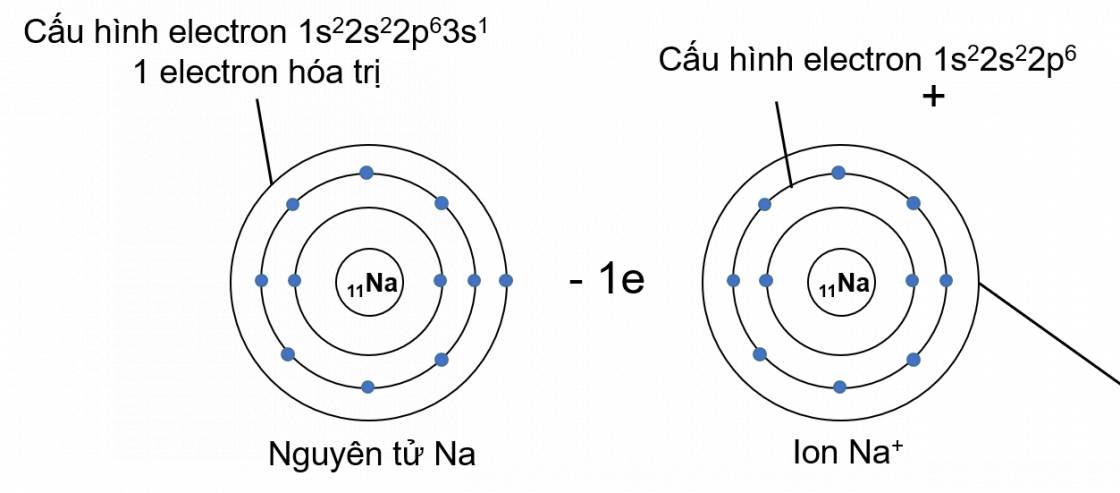
Sự tạo thành ion dương Na+
Ví dụ 2:
Cấu hình electron của nguyên tử Cl (Z = 17): 1s22s22p63s23p5.
→ Có 7 electron ở lớp ngoài cùng (hay có 7 electron hóa trị)
Nguyên tử Cl nhận 1 electron để tạo thành ion âm Cl- (anion chloride).
Cl + 1e → Cl-

Sự tạo thành ion âm Cl-
Chú ý:
- Số đơn vị điện tích của ion dương (cation) hoặc ion âm (anion) bằng số electron mà nguyên tử đã nhường hoặc nhận.
Sự hình thành liên kết ion:
- Các ion thường có cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với nguyên tố tạo thành ion đó trong bảng tuần hoàn.
- Lực hút tĩnh điện giữa các ion mang điện trái dấu trong phân tử (hay tinh thể) tạo ra liên kết ion.
- Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình. Các hợp chất tạo nên từ các ion được gọi là những hợp chất ion.
Ví dụ: Xét sự tạo thành liên kết hóa học trong phân tử sodium chloride (NaCl):
Khi kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na+ và Cl-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
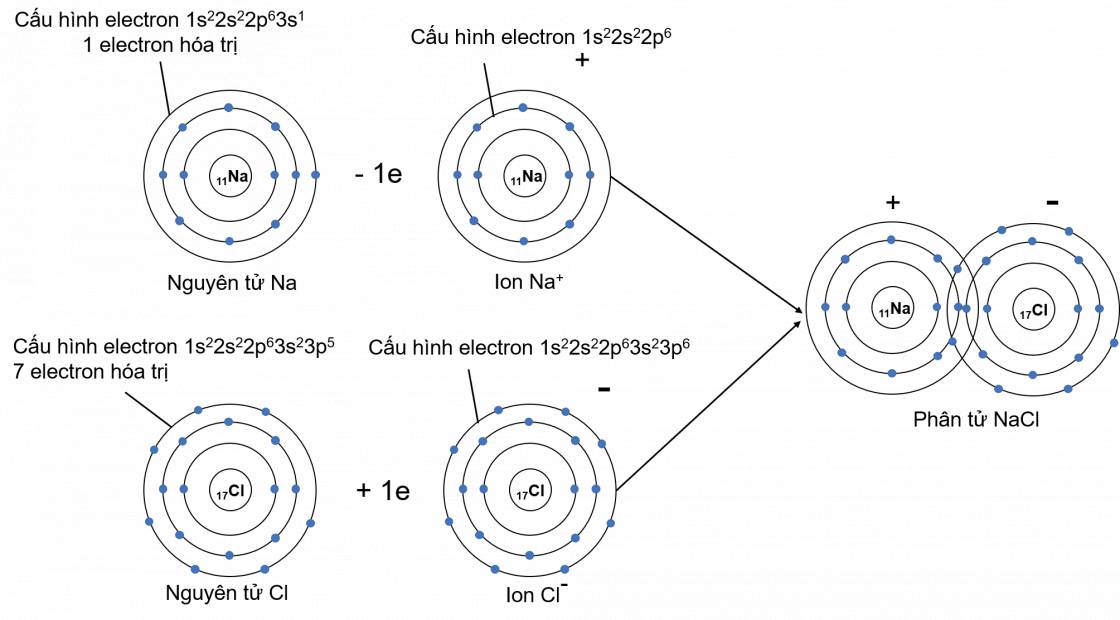
- Phương trình minh họa: 2Na + Cl2 ➙ 2NaCl.
II. Tinh thể ion
Sự tạo thành tinh thể ion
- Các ion được sắp xếp theo một trật tự xác định trong không gian theo kiểu mạng lưới, trong đó ở các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên, liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy (các ion cùng dấu đẩy nhau), tạo thành mạng tinh thể ion.
Ví dụ: Tinh thể muối ăn NaCl
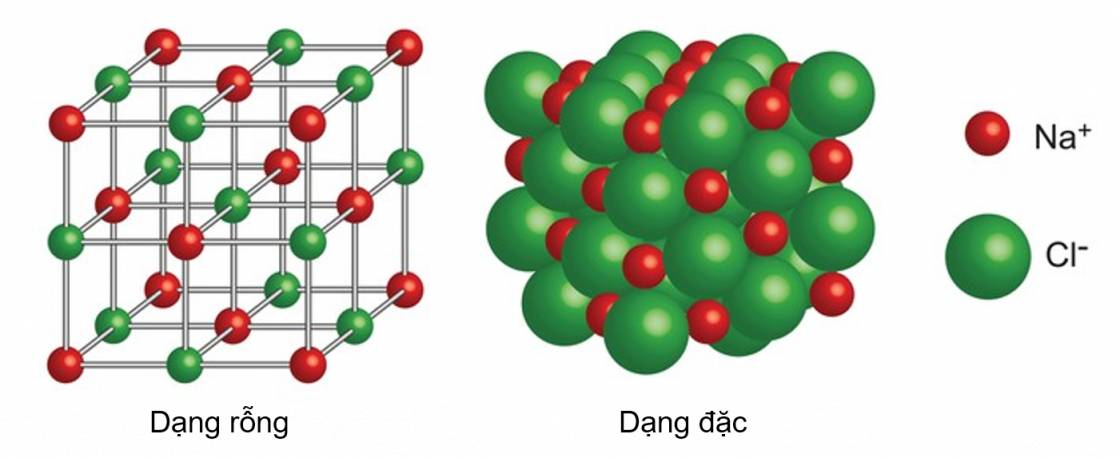
Mô hình tinh thể NaCl
Độ bền và tính chất của hợp chất ion
- Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
- Các tinh thể ion khá rắn chắc, nhưng khá giòn. Đây là tính chất đặc trưng của tinh thể ion.
Ví dụ: Tinh thể muối ăn ở dạng rắn, cứng, nhưng khi tác dụng một lực mạnh thì vỡ vụn.
Các hợp chất ion có khả năng dẫn điện khi tan trong nước hay khi nóng chảy.
Các em đã học:
1. Nguyên tử nhường electron tạo thành cation hoặc nhận electron tạo thành anion.
2. Liên kết ion trong phân tử hay tinh thể được tạo thành nhờ lực hút tĩnh điện của các ion mang điện tích trái dấu. Liên kết ion thường tạo thành từ các nguyên tử kim loại điển hình và phi kim điển hình, phân tử thu được là hợp chất ion.
3. Cấu trúc của mạng tinh thể ion: các ion được sắp xếp theo trật tự nhất định trong không gian theo kiểu mạng lưới (ở các nút mạng là các ion dương và ion âm xếp luân phiên liên kết chặt chẽ với nhau do cân bằng lực hút và lực đẩy).
4. Các hợp chất ion thường là chất rắn có nhiệt độ nóng chảy và nhiệt độ sôi cao, có khả năng dẫn điện khi tan trong nước hay khi nóng chảy.

Bạn có thể đánh giá bài học này ở đây