Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
A. NHÔM
I. VỊ TRÍ TRONG BẢNG TUẦN HOÀN, CẤU HÌNH ELECTRON NGUYÊN TỬ
- Nhôm nằm ở ô số 13, nhóm IIIA, chu kì 3 của bảng tuần hoàn.
- Cấu hình electron: 1s22s22p63s23p1.
- Dễ nhường 3 electron hóa trị nên có số oxi hóa +3 trong các hợp chất.
II. TÍNH CHẤT VẬT LÍ
- Là kim loại màu trắng bạc, nóng chảy ở 660oC, khá mềm, dễ kéo sợi, dễ dát mỏng.
- Là kim loại nhẹ, dẫn điện và dẫn nhiệt tốt (tốt hơn sắt nhưng kém hơn đồng).

III. TÍNH CHẤT HÓA HỌC
Nhôm là kim loại có tính khử mạnh, chỉ sau kim loại kiềm và kiềm thổ, dễ bị oxi hóa thành ion dương.

1. Tác dụng với phi kim
Nhôm dễ dàng khử các phi kim thành ion âm.
a. Tác dụng với halogen
Bột nhôm tự bốc cháy khi tiếp xúc với clo.
2Al + 3Cl2 ➜ 2AlCl3
Phản ứng của nhôm với iot
b. Tác dụng với oxi
Bột nhôm cháy trong không khí với ngọn lửa sáng chói, tỏa nhiều nhiệt.
4Al + 3O2 \(\underrightarrow{t^o}\) 2Al2O3
Do có một lớp màng Al2O3 rất mỏng và bền bảo vệ nên nhôm bền trong không khí ở nhiệt độ thường.
2. Tác dụng với axit
Nhôm dễ dàng khử các ion H+ trong dung dịch HCl, H2SO4 loãng thành khí H2.
2Al + 6HCl ➜ 2AlCl3 + 3H2
Với dung dịch HNO3 và H2SO4, nếu là dung dịch đặc nguội, nhôm bị thụ động và không phản ứng với chúng. Còn lại, nhôm tác dụng mạnh với dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Al + 4HNO3 loãng \(\underrightarrow{t^o}\) Al(NO3)3 + NO + 2H2O
2Al + 6H2SO4 đặc \(\underrightarrow{t^o}\) Al2(SO4)3 + 3SO2 + 6H2O
3. Tác dụng với oxit kim loại
Ở nhiệt độ cao, Al khử được nhiều oxit của các kim loại đứng sau nhôm trong dãy hoạt động hóa học.
2Al + Fe2O3 \(\underrightarrow{t^o}\) Al2O3 + 2Fe
Phản ứng này được gọi là phản ứng nhiệt nhôm. Lượng nhiệt của phản ứng sinh ra rất lớn làm nóng chảy Fe vừa tạo thành nên phản ứng này được ứng dụng để điều chế một lượng nhỏ sắt nóng chảy khi hàn đường ray.
4. Tác dụng với nước
Ở điều kiện thường, do trên bề mặt nhôm có một lớp màng Al2O3 mỏng, rất bền và mịn bảo vệ, không cho nước và khí thấm qua nên nhôm không tác dụng được với nước.
Nếu phá bỏ lớp oxit trên bề mặt nhôm thì nhôm sẽ tác dụng được với nước ở nhiệt độ thường.
2Al + 6H2O ➜ 2Al(OH)3 + 3H2 (1)
5. Tác dụng với dung dịch kiềm
Khi cho nhôm tác dụng với dung dịch kiềm, lớp oxit Al2O3 trên bề mặt nhôm là oxit lưỡng tính nên sẽ phản ứng với dung dịch kiềm tạo ra muối tan. Sau đó, khi không còn lớp oxit bảo vệ, nhôm sẽ tác dụng với nước tạo ra Al(OH)3 và giải phóng khí H2, Al(OH)3 là axit lưỡng tính nên lại tiếp tục tác dụng với dung dịch kiềm.
Al(OH)3 + NaOH ➜ NaAlO2 + 2H2O (2)
Vậy phản ứng của nhôm với dung dịch kiềm xảy ra theo phương trình (1) và (2). Cộng (1) với (2) ta có phương trình tổng quát sẽ của phản ứng là:
2Al + 2NaOH + 2H2O ➜ 2NaAlO2 + 3H2
Vậy, nhôm có thể tác dụng với dung dịch kiềm và giải phóng khí hidro.
IV. ỨNG DỤNG VÀ TRẠNG THÁI TỰ NHIÊN
1. Ứng dụng
- Nhôm và hợp kim nhôm nhẹ, bền với không khí và nước nên dùng làm vật liệu chế tạo máy bay, ô tô, tàu vũ trụ.
- Nhôm và hợp kim nhôm có màu trắng bạc, đẹp nền dùng trong xây dựng nhà cửa, trang trí nội thất.
- Dẫn điện tốt nên dùng làm dây điện thay cho đồng. Dẫn nhiệt tốt và ít bị gỉ, không độc nên làm dụng cụ nhà bếp.
- Hỗn hợp tecmit (bột nhôm trộn với bột sắt oxit) dùng để hàn đường ray.

2. Trạng thái tự nhiên
Nhôm là nguyên tố phổ biến thứ 3 ở lớp vỏ trái đất nhưng chỉ tồn tại ở trong tự nhiên ở dạng hợp chất do chúng là kim loại hoạt động mạnh.
Hợp chất của nhôm có thể kể đến như đất sét, mica, quặng boxit (Al2O3.2H2O), criolit (3NaF.AlF3),...

V. SẢN XUẤT NHÔM
Nhôm được sản xuất trong công nghiệp bằng phương pháp điện phân nhôm oxit nóng chảy.
1. Nguyên liệu
Nguyên liệu để sản xuất nhôm là quặng boxit Al2O3.2H2O. Loại bỏ tạp chất Fe2O3 và SiO2 có lẫn ra khỏi quặng trước khi sản xuất, ta thu được Al2O3 gần như nguyên chất.
2. Điện phân nhôm oxit nóng chảy
Trước hết phải hòa tan Al2O3 (tonc 2050oC) vào trong criolit nóng chảy (3NaF.AlF3) để hạ nhiệt độ nóng chảy của hỗn hợp xuống 900oC. Việc này vừa tiết kiệm được năng lượng, vừa tạo được chất lỏng dẫn điện tốt hơn. Mặt khác, hỗn hợp này có khối lượng riêng nhỏ hơn nhôm, sẽ nổi lên trên bề mặt nhôm nóng chảy mới được điều chế và ngăn chúng không bị oxi hóa bởi oxi trong không khí.
Quá trình điện phân:
Cực âm (catot) của thùng điện phân là một tấm than chì nguyên chất được bố trí ở đáy thùng. Ở catot xảy ra quá trình khử ion Al3+ thành AI:
Al3+ + 3e ➜ AI
Nhôm nóng chảy được định kì tháo ra từ đáy thùng.
Cực dương (anot) cũng là những khối than chì lớn. Ở anot xảy ra quá trình oxi hoá ion O2- thành khí O2.
2O2- ➜ O2 + 4e
Khí O2 ở nhiệt độ cao đốt cháy C thành khí CO và CO2. Vì vậy, sau một thời gian phải thay thế điện cực dương.

B. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA NHÔM
I. NHÔM OXIT Al2O3
1. Tính chất
- Là chất rắn, màu trắng, không tan trong nước và không tác dụng với nước.
- Là oxit lưỡng tính, vừa tác dụng với axit, vừa tác dụng với bazơ.
Al2O3 + 6HCl ➝ 2AlCl3 + 3H2O
Al2O3 + 2NaOH ➝ 2NaAlO2 (natri aluminat) + H2O

2. Ứng dụng
- Dạng oxit ngậm nước là thành phần của quặng boxit dùng để sản xuất nhôm.
- Dạng oxit khan có cấu tạo tinh thể đá quý, ít phổ biến hơn dạng ngậm nước, dùng để chế tạo đá mài, giấy nhám.
- Bột nhôm oxit dùng trong công nghiệp sản xuất chất xúc tác cho tổng hợp hữu cơ.
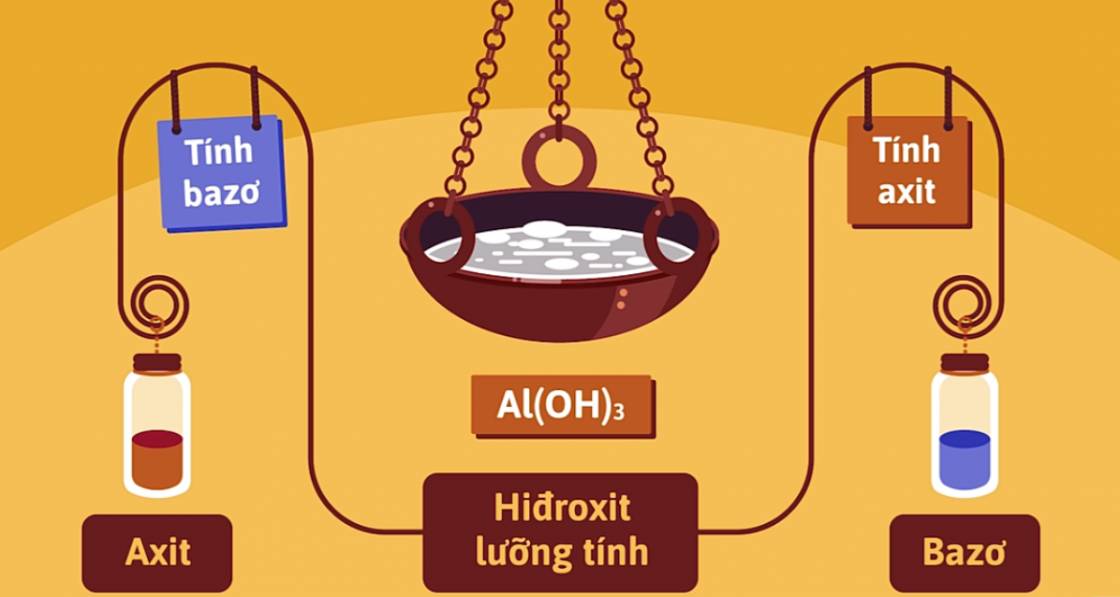
II. NHÔM HIDROXIT Al(OH)3
- Là chất rắn, màu trắng, kết tủa ở dạng keo.
- Là hidroxit lưỡng tính.
Al(OH)3 + HCl ➝ AlCl3 + H2O
Al(OH)3 + NaOH ➝ NaAlO2 + 2H2O
- Nhôm hidroxit thể hiện tính bazơ trội hơn tính axit. Do có tính axit yếu nên nhôm hidroxit còn có tên gọi là axit aluminic, là axit rất yếu, yếu hơn axit cacbonic.
III. NHÔM SUNFAT Al2(SO4)3
- Muối kép của nhôm và kali ngậm nước gọi là phèn chua, công thức: K2SO4.Al2(SO4)3.24H2O, hay viết gọn là: KAl(SO4)2.12H2O. Phèn chua được dùng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong công nghiệp nhuộm vải, làm trong nước.
- Nếu thay ion K+ bằng Li+, Na+ hay NH4+ ta được các muối kép khác có tên gọi chung là phèn nhôm (nhưng không phải là phèn chua).
IV. CÁCH NHẬN BIẾT ION Al3+ TRONG DUNG DỊCH
Cho từ từ dung dịch NaOH đến dư vào dung dịch thí nghiệm, nếu thấy có kết tủa keo trắng xuất hiện rồi tan trong NaOH dư thì chứng tỏ có ion Al3+.
Al3+ + 3OH- ➝ Al(OH)3
Al(OH)3 + OH- ➝ AlO2- + 2H2O
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây