Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. VỊ TRÍ CỦA KIM LOẠI TRONG BẢNG TUẦN HOÀN
Trong bảng tuần hoàn, các nguyên tố kim loại có mặt ở:
- Nhóm IA (trừ hidro), nhóm IIA, nhóm IIIA (trừ Bo) và một phần của các nhóm IVA, VA, VIA.
- Các nhóm B (từ IB đến VIIIB).
- Họ lantan và actini, được xếp riêng thành 2 hàng cuối bảng.
II. CẤU TẠO CỦA KIM LOẠI
1. Cấu tạo nguyên tử
Nguyên tử của các nguyên tố kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng. Ví dụ:
11Na: 1s22s22p63s1. 12Mg: 1s22s22p63s2. 13Al: 1s22s22p63s23p1.
Trong một chu kì, bán kính nguyên tử của nguyên tố kim loại lớn và điện tích hạt nhận thì hỏ hơn hơn so với nguyên tử nguyên tố phi kim.
2. Cấu tạo tinh thể
Thủy ngân là kim loại duy nhất tồn tại ở thể lỏng ở điều kiện thường, còn các kim loại khác ở thể rắn và có cấu tạo tinh thể.
Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng của tinh thể. Các electron hóa trị liên kết yếu với hạt nhân nên dễ tách khỏi nguyên tử và chuyển động tự do trong mạng tinh thể.
Có 3 kiểu mạng tinh thể kim loại phổ biến sau:
a. Mạng tinh thể lục phương
Các nguyên tử, ion kim loại nằm trên các đinh và tâm các mặt của hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác
Trong tinh thể, thế tích của các nguyên tử và ion kim loại chiếm 74%, còn lại 26% là không gian trống. Thuộc loại này có các kim loại: Be, Mg, Zn,...
Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương.
Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 74%, còn lại 26% là không gian trống. Thuộc loại này có các kim loại: Cu, Ag. Au, Al.
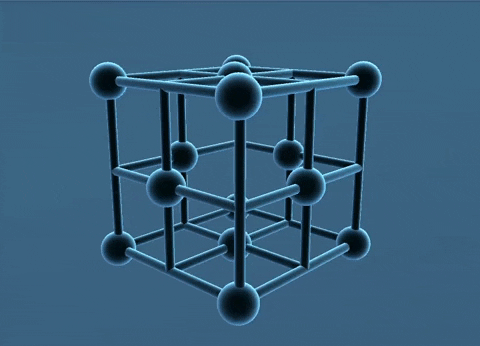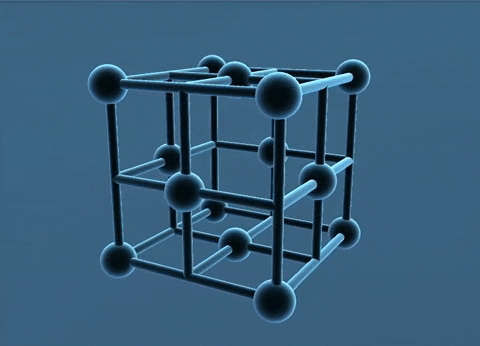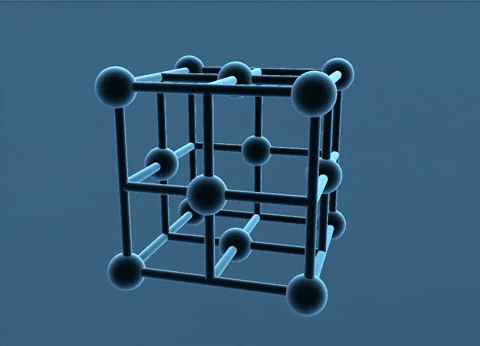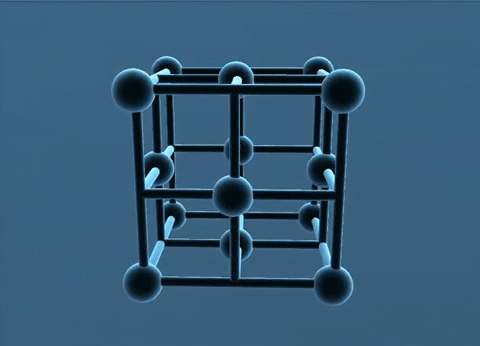
c. Mạng tinh thể lập phương tâm khối
Các nguyên tử, ion kim loại nằm trên các đinh và tâm của hình lập phương.
Trong tinh thể, thể tích của các nguycn tử và ion kim loại chi chiếm 68%, còn lại 32% là không gian trống. Thuộc loại này có các kim loại: Li, Na, K, V, Mo,...

3. Liên kết kim loại
Ở trạng thái lỏng và rắn, các nguyên tử kim loại liên kết với nhau bằng một kiểu liên kết hóa học riêng gọi là liên kết kim loại.
Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.

Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây