Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. ĐỊNH NGHĨA, PHÂN LOẠI
1. Định nghĩa
Phenol là những hợp chất hữu cơ trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen. Nhóm -OH này được gọi là nhóm -OH phenol.
Phenol đơn giản nhất là C6H5-OH, phân tử gồm 1 nhóm -OH liên kết với gốc phenyl.

Lưu ý: Phân biệt phenol và ancol thơm.
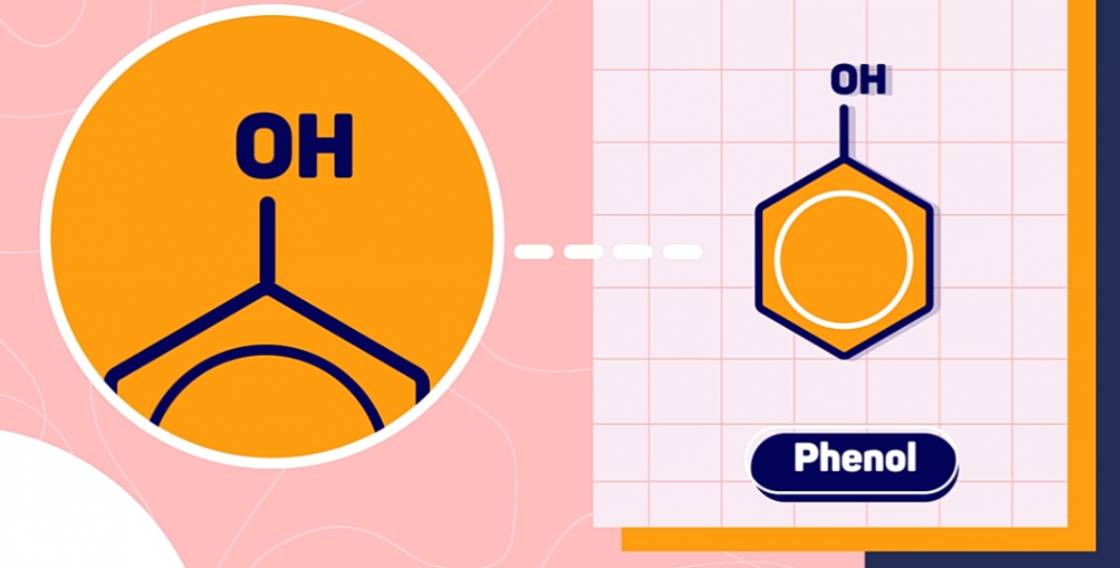
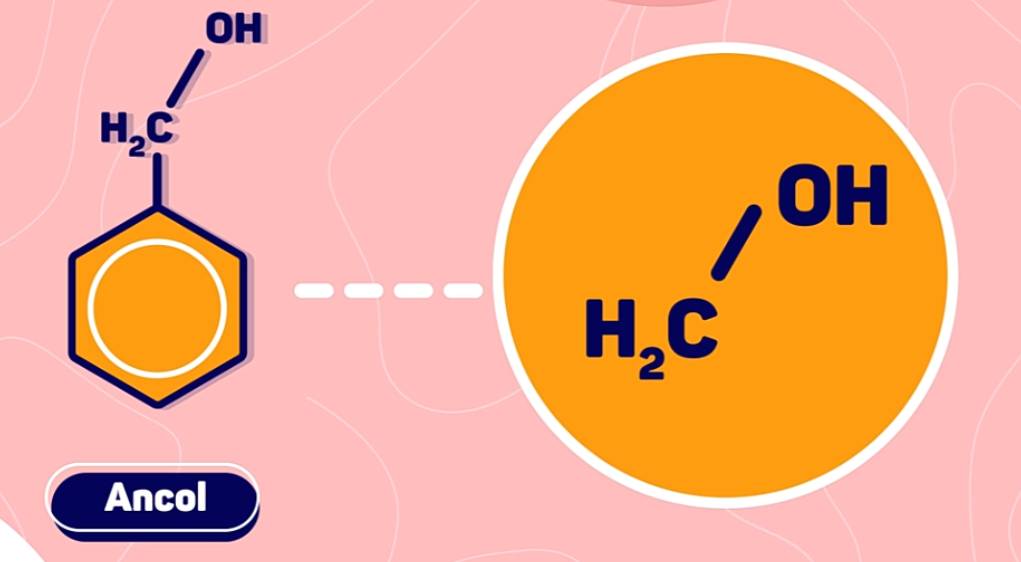
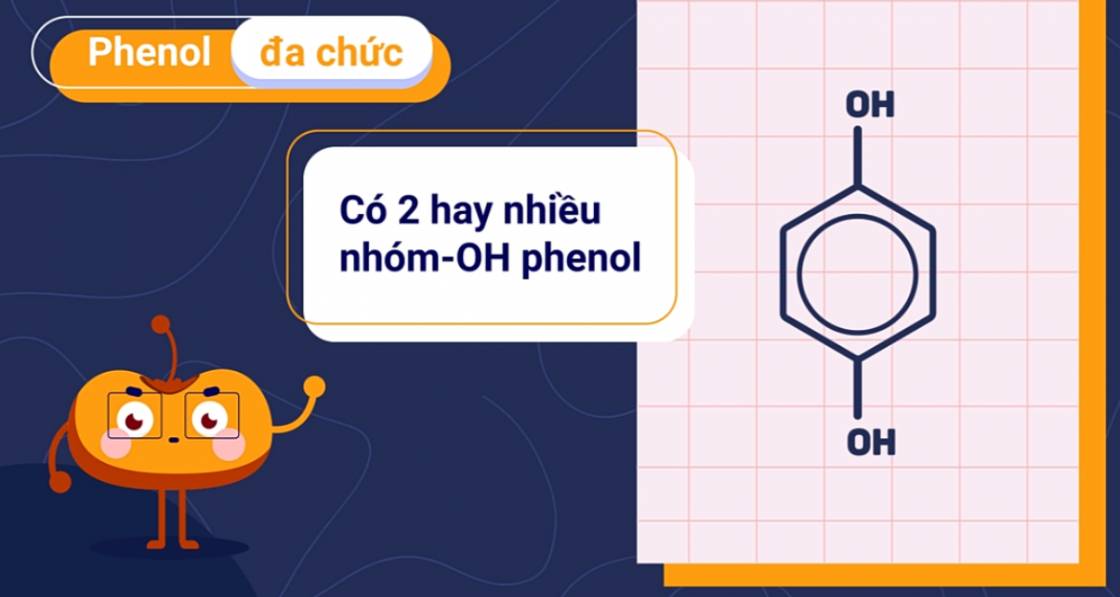
2. Phân loại
Phenol được phân loại dựa theo số lượng nhóm -OH trong phân tử.
| Phenol đơn chức | Phenol đa chức |
|
|
II. Phenol
1. Cấu tạo
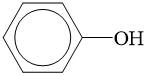
- Công thức phân tử: C6H6O
- Công thức cấu tạo: C6H5-OH hay
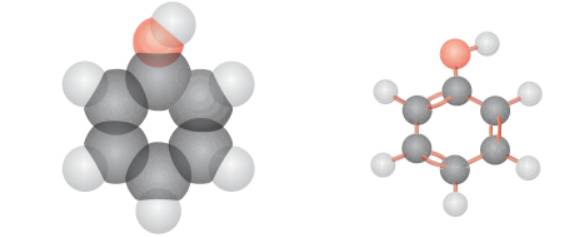
Mô hình phân tử của phenol dạng đặc và dạng rỗng.
2. Tính chất vật lý
- Ở điều kiện thường phenol là chất rắn, không màu, nóng chảy ở 43oC. Để lâu, phenol chuyển thành màu hồng do bị oxi hóa chậm trong không khí.
- Phenol rất độc, gây bỏng nặng khi dây vào da.
- Phenol ít tan trong nước lạnh nhưng tan nhiều trong nước nóng và etanol, ete, axeton. Ở 66oC phenol tan vô hạn.
3. Tính chất hóa học
Do nhóm -OH liên kết trực tiếp với vòng benzen gây ra hiệu ứng liên hợp dẫn đến các hệ quả:
- Liên kết -O-H trở nên phân cực hơn, nguyên tử H linh động hơn so với H trong nhóm -OH ancol.
- Liên kết C-O trở nên bền vững hơn so với ancol, vì thế nhóm -OH phenol không bị thế bởi gốc axit như nhóm -OH ancol.
- Phenol có tính axit yếu.
a) Tính axit
Tuy có tính axit nhưng phenol không làm đổi màu quỳ tím vì tính axit của phenol rất yếu.
Tính axit của phenol mạnh hơn ancol (phản ứng được cả với dung dịch kiềm) nhưng yếu hơn cả axit cacbonic và bị axit cacbonic đẩy ra khỏi phenolat.
C6H5-ONa + CO2 + H2O → C6H5OH + NaHCO3
b) Phản ứng thế nguyên tử H của nhóm -OH
Tác dụng với kim loại kiềm
2C6H5OH + 2Na  2C6H5ONa + H2
2C6H5ONa + H2
Tác dụng với dung dịch bazo
C6H5OH + NaOH → C6H5ONa + H2O
Nhận xét: Vòng benzen đã làm tăng khả năng phản ứng của nguyên tử H thuộc nhóm -OH trong phân tử phenol so với trong phân tử ancol.
b) Phản ứng thế nguyên tử H của vòng benzen
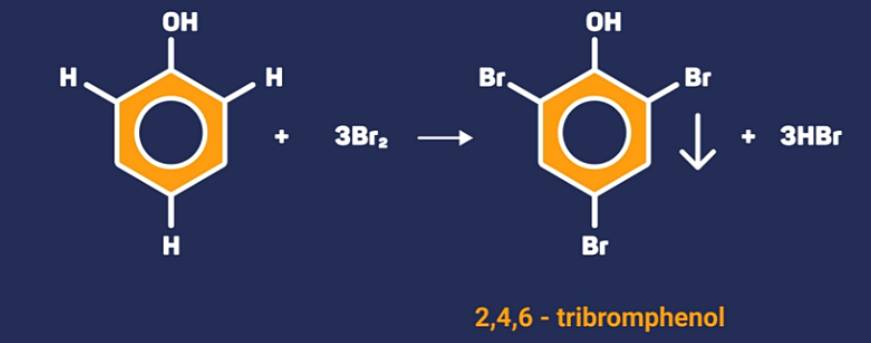
Phenol phản ứng với dung dịch brom tạo kết tủa trắng là 2,4,6-tribromphenol.
.gif)
Do có tính chất này, dung dịch brom cũng được dùng để nhận biết phenol.
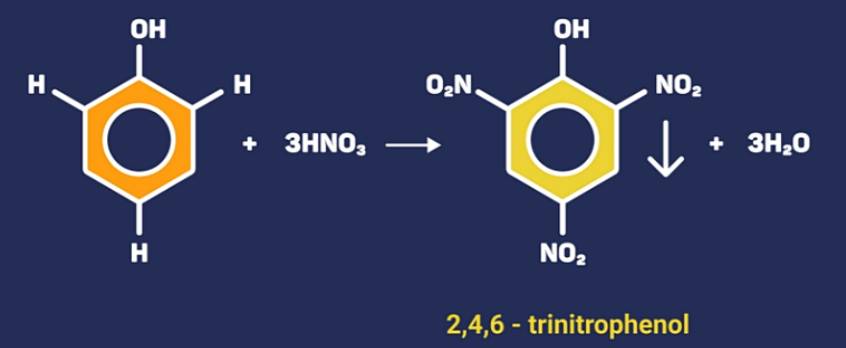
Nếu cho phenol phản ứng với dung dịch HNO3 thì thu được kết tủa màu vàng là 2,4,6-trinitrophenol (axit picric).
.gif)
Nhận xét: Nguyên tử H của vòng benzen trong phân tử phenol dễ bị thay thế hơn nguyên tử H của vòng benzen trong phân tử các hidrocacbon thơm. Đó là do ảnh hưởng của nhóm -OH tới vòng benzen.
Ảnh hưởng của vòng benzen tới nhóm -OH và ảnh hưởng của nhóm -OH đến vòng benzen được gọi là ảnh hưởng qua lại giữa các nguyên tử trong phân tử.
4. Điều chế
Trong công nghiệp, phenol được điều chế bằng cách oxi hóa cumen nhờ oxi không khí rồi thủy phân trong dung dịch axit H2SO4 loãng.
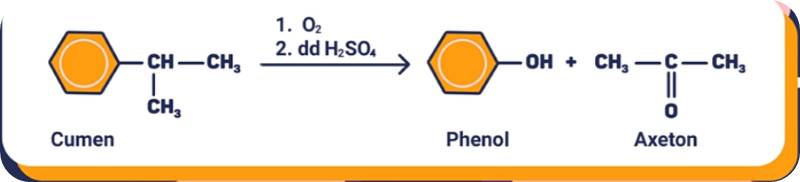
Phenol cũng được điều chế theo sơ đồ sau
C6H6 → C6H5Br → C6H5ONa → C6H5OH
Ngoài ra phenol cũng được tách ra từ nhựa than đá trong quá trình luyện cốc.
5. Ứng dụng
Phenol là nguyên liệu để sản xuất nhựa phenol-fomandehit dùng chế tạo các đồ dân dụng, nhựa ure-fomandehit dùng làm chất kết dính như keo dán gỗ, dán kim loại, sành, sứ...
Phenol còn dùng để sản xuất phẩm nhuộm, thuốc nổ, chất diệt cỏ, chất diệt nấm mốc...

Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cộng đồng Hoc24.vn cùng thảo luận và trả lời nhé. Chúc các em học tốt!


Bạn có thể đánh giá bài học này ở đây