Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. Thuyết cấu tạo hóa học
1. Nội dung của thuyết cấu tạo hóa học
Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hóa trị và theo một thứ tự nhất định. Thứ tự liên kết đó được gọi là cấu tạo hóa học. Sự thay đổi cấu tạo liên kết đó, tức là thay đổi cấu tạo hóa học, sẽ tạo ra hợp chất khác.
Ví dụ: Công thức phân tử \(C_2H_6O\) có 2 công thức cấu tạo ứng với 2 hợp chất sau có thứ tự liên kết khác nhau:
\(H_3C-O-CH_3\): đimetyl ete, chất khí, không tác dụng với Na.
\(H_3C-CH_2-O-H\): ancol etylic, chất lỏng, tác dụng với Na giải phóng khí Hidro.
Trong phân tử hợp chất hữu cơ, cacbon có hóa trị 4. Nguyên tử cacbon không những có thể liên kết với nguyên tử của các nguyên tố khác mà còn liên kết với nhau thành mạch cacbon.
Ví dụ:
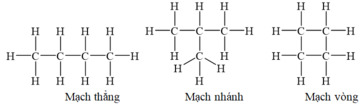
Tính chất của các chất phụ thuộc vào thành phần phân tử (bản chất, số lượng, các nguyên tử) và cấu tạo hóa học (thứ tự liên kết các nguyên tử).
Ví dụ:
Phụ thuộc vào thành phần phân tử:
- \(CH_4\) là chất khí dễ cháy, \(CCl_4\) là chất lỏng không cháy.
- \(CH_3Cl\) là chất khí không có tác dụng gây mê, \(CHCl_3\) là chất lỏng có tác dụng gây mê.
Phụ thuộc vào cấu tạo hóa học:
- \(CH_3CH_2OH\) và \(CH_3OCH_3\) khác nhau cả về tính chất vật lý và tính chất hóa học.
2. Đồng đẳng, đồng phân
a. Đồng đẳng
Khái niệm: Những hợp chất có thành phần phân tử hơn kém nhau một hay nhiều nhóm \(CH_2\) nhưng có tính chất hóa học tương tự nhau là những chất đồng đẳng, chúng hợp thành dãy đồng đẳng.
Ví dụ:
Các hidrocacbon trong dãy: \(CH_4,C_2H_6,C_3H_8,C_4H_{10},C_5H_{12},...,C_nH_{2n+2}\), chất sau hơn chất trước một nhóm \(CH_2\) nhưng đều có tính chất hóa học tương tự nhau.
Các ancol trong dãy: \(CH_3OH,C_2H_5OH,C_3H_7OH,C_4H_9OH,...,C_nH_{2n+1}\) cũng có thành phần hơn kém nhau một hay nhiều nhóm \(CH_2\) nhưng có tính chất hóa học tương tự nhau.
Giải thích: mặc dù các chất trong cùng dãy đồng đẳng có công thức phân tử khác nhau một hay nhiều nhóm \(CH_2\) nhưng do chúng có cấu tạo hóa học tương tự nhau nên có tính chất hóa học tương tự nhau.
b. Đồng phân
Khái niệm: những hợp chất khác nhau nhưng có cùng công thức phân tử là những chất đồng phân.
Ví dụ:
Etanol và đimetyl ete (có tính chất khác nhau) nhưng lại có cùng công thức phân tử là \(C_2H_6O\).

Etanol\(\left(C_2H_5OH\right)\) Đimetyl ete \(\left(CH_3OCH_3\right)\)
Giải thích: những chất đồng phân tuy có cùng công thức phân tử nhưng có cấu tạo hóa học khác nhau, chẳng hạn etanol có cấu tạo \(H_3C-CH_2-O-H\), còn đimetyl ete có cấu tạo \(H_3C-O-CH_3\) , vì vậy chúng là những chất khác nhau, có tính chất khác nhau.
II. Liên kết trong phân tử hợp chất hữu cơ
1. Các loại liên kết trong phân tử hợp chất hữu cơ
Theo Lewis, các nguyên tử có xu hướng dùng chung electron để đạt được 8 electron ở lớp ngoài cùng (riêng đối với H chỉ cần 2 electron ngoài cùng.
Ví dụ:
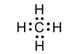 hoặc
hoặc 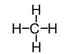
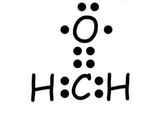 hoặc
hoặc 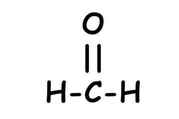
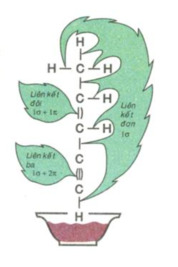
Liên kết được tạo bởi 1 cặp electron dùng chung là liên kết đơn. Liên kết đơn thuộc loại liên kết \(\sigma\).Liên kết đơn được biểu diễn bởi 2 dấu chấm hay 1 gạch nối giữa 2 nguyên tử.
Liên kết được tạo bởi 2 cặp electron dùng chung là liên kết đôi. Liên kết đôi gồm 1 liên kết \(\sigma\) và 1 liên kết \(\pi\). Biểu diễn bởi 4 dấu chấm hay 2 gạch nối.
Liên kết được tạo bởi 3 cặp electron dùng chung là liên kết đôi. Liên kết đôi gồm 1 liên kết \(\sigma\)và 2 liên kết \(\pi\). Biểu diễn bởi 6 dấu chấm hay 3 gạch nối.
Liên kết đôi và liên kết ba được gọi chung là liên kết bội.
2. Các loại công thức cấu tạo
Có 3 cách viết công thức cấu tạo: khai triển, thu gọn và thu gọn nhất.
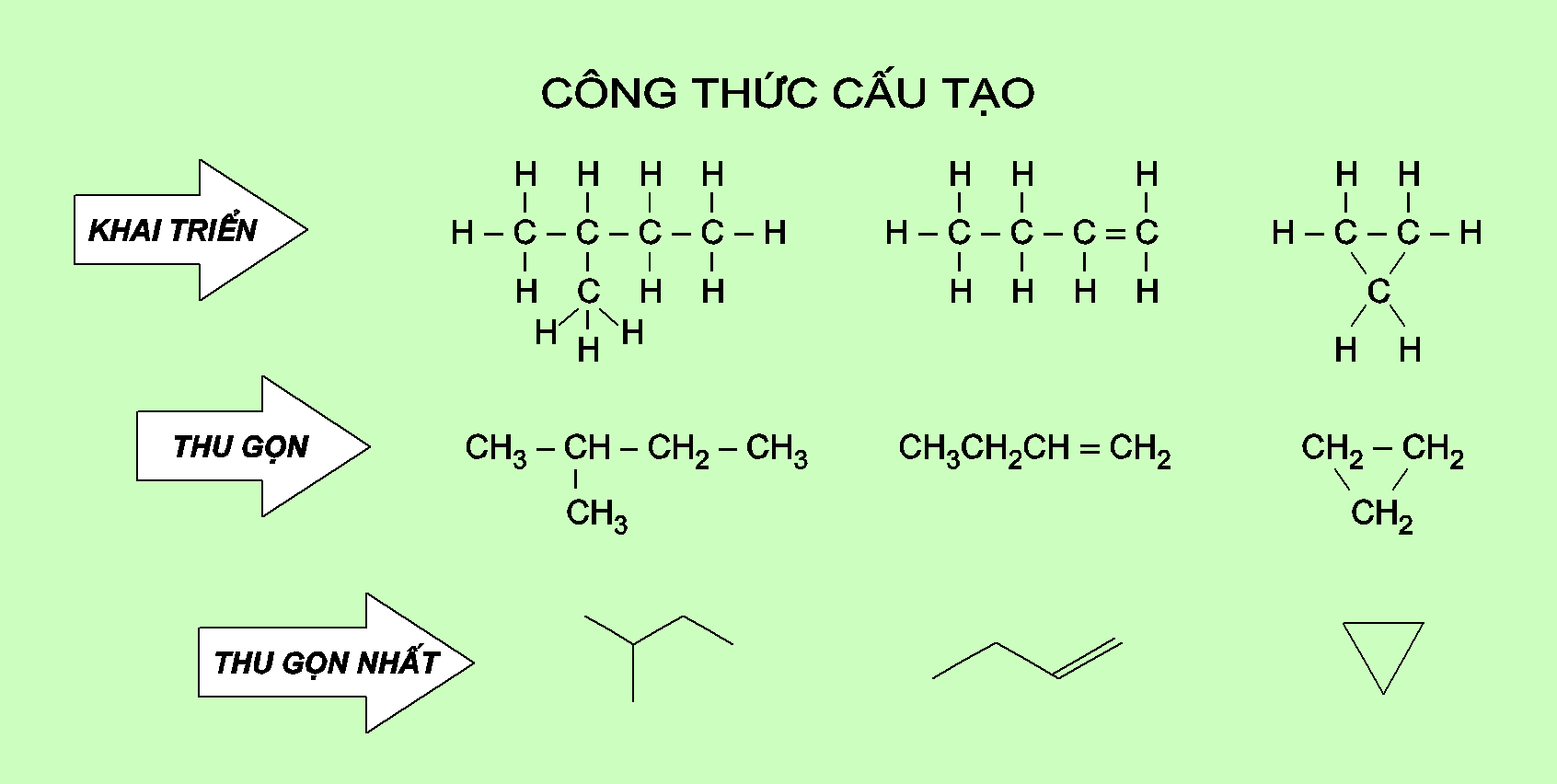
Công thức cấu tạo khai triển: viết tất cả các nguyên tử và các liên kết giữa chúng.
Công thức cấu tạo thu gọn: viết gộp nguyên tử cacbon và các nguyên tử khác liên kết với nó thành từng nhóm.
Công thức cấu tạo thu gọn nhất: chỉ viết các liên kết và nhóm chức, đầu mút của các liên kết chính là các nhóm \(CH_x\) với x đảm bảo hóa trị 4 ở C.
III. Đồng phân cấu tạo
1. Khái niệm đồng phân cấu tạo
Những hợp chất có cùng công thức phân tử nhưng có cấu tạo hóa học khác nhau gọi là những đồng phân cấu tạo.
Ví dụ:
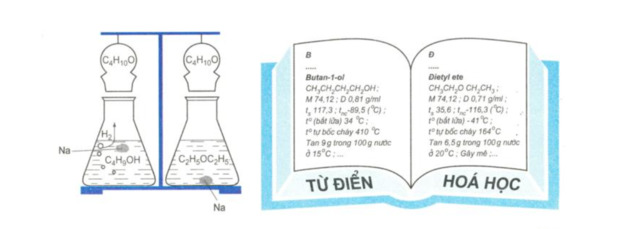
Giải thích: Butan-1-ol và đietyl ete có cùng công thức phân tử \(C_4H_{10}O\) nhưng do khác nhau về cấu tạo hóa học nên khác nhau về tính chất vật lý và tính chất hóa học.
2. Phân loại đồng phân cấu tạo
Những đồng phân khác nhau về bản chất nhóm chức gọi là đồng phân nhóm chức. Những đồng phân khác nhau về sự phân nhánh mạch cacbon gọi là đồng phân mạch cacbon. Những đồng phân khác nhau về vị trí của nhóm chức gọi là đồng phân vị trí nhóm chức.
Ví dụ:
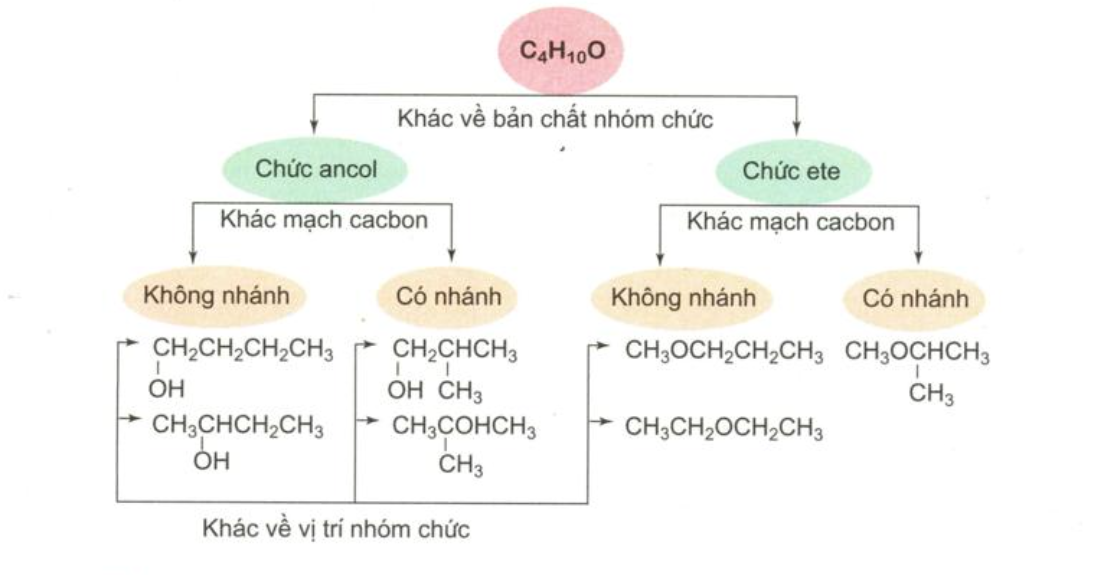
IV. Cách biểu diễn cấu trúc không gian phân tử hữu cơ
1. Công thức phối cảnh
Khái niệm: công thức phối cảnh là một loại công thức lập thể.
Ví dụ:
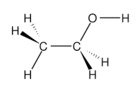
Công thức phối cảnh của  \(C_2H_5OH\)
\(C_2H_5OH\)
Giải thích:
- Đường nét liền biểu diễn liên kết nằm trên mặt trang giấy.
- Đường nét đậm biểu diễn liên kết hướng về mắt ta.
- Đường nét đứt biểu biểu diễn hướng ra xa mắt ta.
2. Mô hình phân tử
Được chia làm 2 loại là mô hình rỗng và mô hình đặc.

V. Đồng phân lập thể
1. Khái niệm đồng phân lập thể
Đồng phân lập thể là những đồng phân có cấu tạo hóa học như nhau nhưng khác nhau về sự phân bố không gian của các nguyên tử trong phân tử.
Ví dụ:
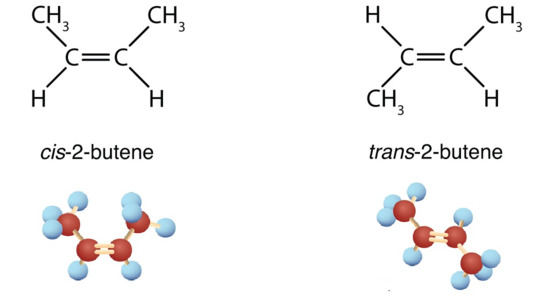
Đồng phân lập thể của \(C_4H_8\)
Giải thích: ứng với công thức cấu tạo \(C_4H_8\) có 2 cách sắp xếp không gian khác nhau dẫn tới 2 chất đồng phân.
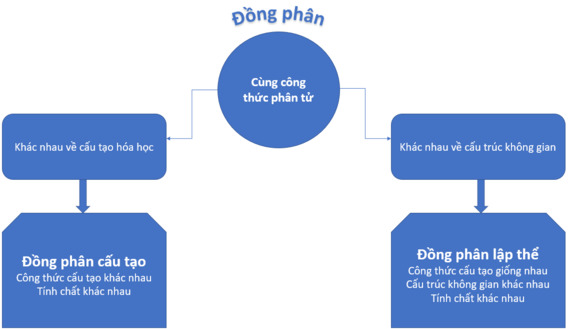
2. Quan hệ giữa đồng phân cấu tạo và đồng phân lập thể
3. Cấu tạo hóa học và cấu trúc hóa học
Cấu tạo hóa học cho ta biết các nguyên tử liên kết với nhau theo thứ tự nào, bằng liên kết đơn hay liên kết bội, nhưng không cho biết sự phân bố trong không gian của chúng. Cấu tạo hóa học được biểu diễn bằng cấu thức cấu tạo.
Cấu tạo hóa học và cấu trúc không gian của phân tử hợp thành cấu trúc hóa học. Cấu trúc hóa học vừa cho biết cấu tạo hóa học vừa cho biết sự phân bố trong không gian của các nguyên tử trong phân tử. Cấu trúc hóa học thường được biểu diến bằng công thức lập thể.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây