Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. NƯỚC LÀ CHẤT ĐIỆN LI RẤT YẾU
1. Sự điện li của nước
Nước điện li rất yếu: H2O ⇌ H+ + OH-
Do nước điện li rất yếu nên nước cũng dẫn điện nhưng cực kì yếu. Thực nghiệm đã xác định rằng, ở nhiệt độ thường cứ 555 triệu phân tử H2O thì chỉ có 1 phân tử phân li ra ion.

2. Tích số ion của nước
Từ phương trình điện li của nước, ta thấy 1 phân tử H2O phân li ra một ion H+ và một ion OH-, nghĩa là trong nước nồng độ H+ bằng nồng độ OH-. Mà nước có môi trường trung tính, nên có thể định nghĩa:
Môi trường trung tính là môi trường trong đó [H+] = [OH-].
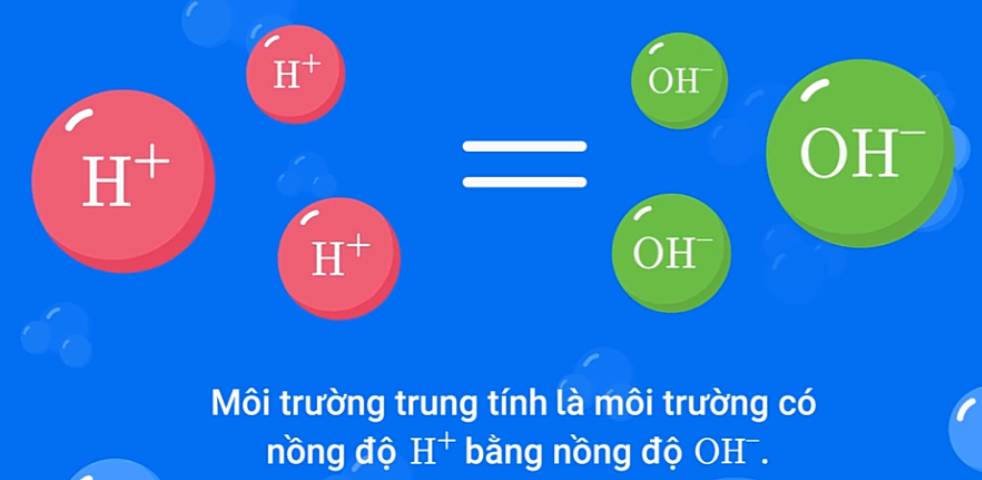
Bằng thực nghiệm, người ta đã xác định được ở 25oC nồng độ của H+ và OH- như sau:
[H+] = [OH-] = 10-7 (mol/l)
Đặt K\(H_2O\left(25^oC\right)\) = [H+] . [OH-] = 10-7. 10-7 = 10-14.
Tích số K\(H_2O\left(25^oC\right)\) = [H+] . [OH-] được gọi là tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định, tuy nhiên giá trị tích số ion của nước là 10-14 thường được dùng trong các phép tính, khi nhiệt độ không khác nhiều 25oC.
Một cách gần đúng, có thể coi giá trị tích số ion của nước là hằng số cả trong dung dịch loãng của các chất khác nhau.

3. Ý nghĩa tích số ion của nước
a. Môi trường axit
Khi hòa tan axit vào nước, nồng độ H+ tăng mà tích số tan của nước không đổi nên nồng độ OH- phải giảm.
Ví dụ. Hòa tan axit HCl vào nước thu được dung dịch axit có nồng độ H+ bằng 10-3M, khi đó nồng độ OH- trong dung dịch là:
[OH-] = \(\dfrac{10^{-14}}{10^{-3}}\) = 10-11M
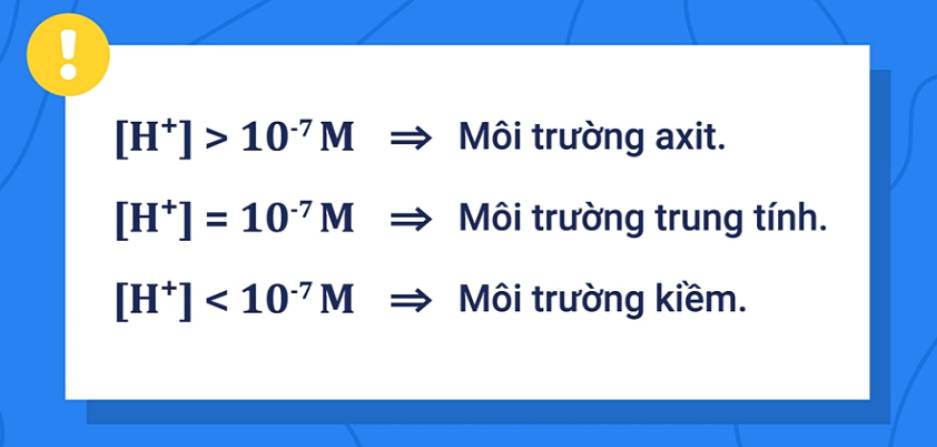
Vậy, môi trường axit là môi trường trong đó [H+] > [OH-] hay [H+] > 10-7M.
b. Môi trường kiềm
Tương tự, khi hòa tan bazơ vào nước, nồng độ OH- tăng, vì vậy nồng độ H+ phải giảm sao cho tích số tan của nước không đổi.
Ví dụ. Hòa tan NaOH vào nước để thu được dung dịch có nồng độ OH- bằng 10-5M, nồng độ H+ khi đó là:
[H+] = \(\dfrac{10^{-14}}{10^{-5}}\) = 10-9 M
Vậy, môi trường bazơ là môi trường trong đó [H+] < [OH-] hay [H+] < 10-7M.
Từ những ví dụ trên, ta thấy nếu biết nồng độ H+ trong dung dịch nước thì cũng xác định được nồng độ OH- và ngược lại. Vì vậy, độ axit và độ kiềm của dung dịch có thể đánh giá chỉ bằng nồng độ H+.
II. KHÁI NIỆM VỀ pH. CHẤT CHỈ THỊ AXIT - BAZƠ
1. Khái niệm về pH
Ta có thể đánh giá độ axit và độ kiềm của dung dịch bằng nồng độ H+. Nhưng dung dịch thường có nồng độ H+ nhỏ. Để thuận tiện và tránh ghi nồng độ H+ với số mũ âm, người ta dùng giá trị pH với quy ước như sau:
[H+] = 10-pH ⇒ pH = -lg[H+]
Nếu [H+] = 10-a M thì pH = a
Ví dụ:
[H+] = 10-2 M ⇒ pH = 2; môi trường axit.
[H+] = 10-7 M ⇒ pH = 7; môi trường trung tính.
[H+] = 10-10 M ⇒ pH = 10; môi trường kiềm.
Thang pH thường có giá trị từ 1 đến 14.
2. Chất chỉ thị axit - bazơ
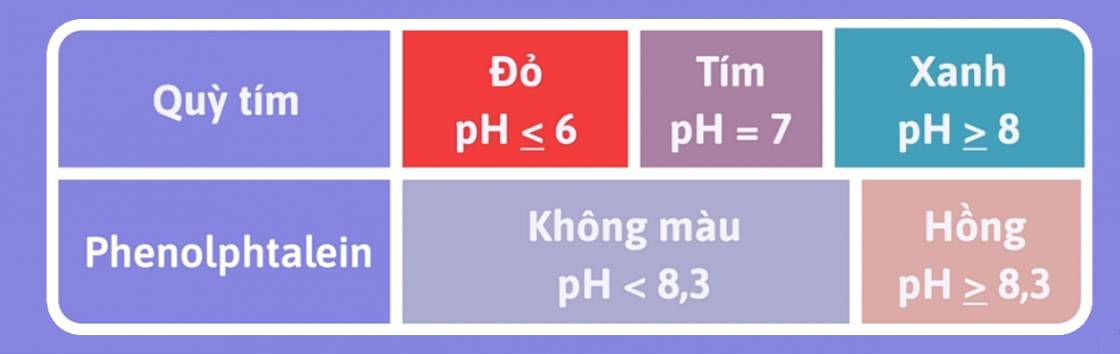
Chất chỉ thị axit - bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch. Có 2 chất chỉ thị phổ biến và hay dùng là quỳ tím và dung phenolphtalein.

Màu của hai chất chỉ thị axit - bazơ là quỳ tím và phenolphtalein trong dung dịch ở các khoảng pH khác nhau như sau:
Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH, ta được hỗn hợp chất chỉ thị vạn năng.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây