Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. ĐỊNH NGHĨA, PHÂN LOẠI, DANH PHÁP
1. Định nghĩa
- Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl -COOH liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hidro.
- Nhóm cacboxyl -COOH gọi là nhóm chức của axit cacboxylic.
Ví dụ: H-COOH; CH3-COOH; HOOC-COOH (axit oxalic).
2. Phân loại
Các axit cacboxylic được phân loại dựa vào đặc điểm cấu tạo gốc hidrocacbon và số lượng nhóm cacboxyl -COOH trong phân tử.
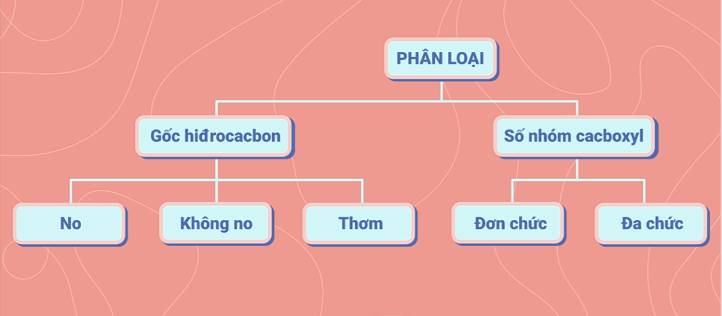
- Axit no, đơn chức, mạch hở: Phân tử gồm gốc ankyl hoặc H liên kết với một nhóm -COOH. Các axit này lập thành dãy đồng đẳng của axit no, đơn chức, mạch hở có công thức cấu tạo chung là CnH2n+1COOH (n≥0) và công thức phân tử chung là CmH2mO2 (m≥1).
- Axit không no, đơn chức, mạch hở: Phân tử có gốc hidrocacbon không no, mạch hở liên kết với một nhóm -COOH. Ví dụ: CH2=CH-COOH (axit acrylic).
- Axit thơm, đơn chức: Phân tử có gốc hidrocabon thơm liên kết với một nhóm -COOH. Ví dụ: C6H5COOH (axit benzoic).
- Axit đa chức: Phân tử có từ 2 nhóm -COOH trở lên. Ví dụ: HOOC-(CH2)4-COOH (axit ađipic), HOOC-CH2-COOH (axit malonic).
3. Danh pháp
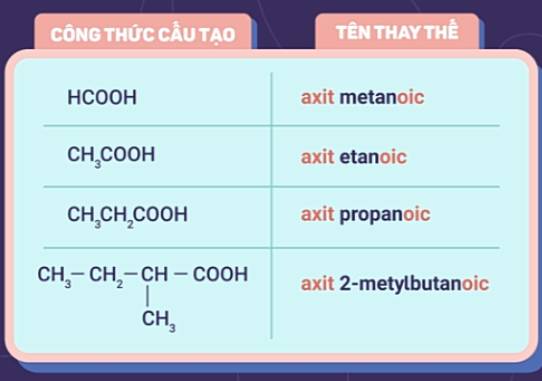
a) Tên thay thế
| Tên axit cacboxylic = Axit + tên hidrocacbon no tương ứng với mạch chính + oic |
Lưu ý:
- Mạch chính của phân tử axit là mạch cacbon dài nhất bắt đầu từ nhóm -COOH.
- Mạch cacbon được đánh số bắt đầu từ nguyên tử cacbon của nhóm -COOH.
Ví dụ:
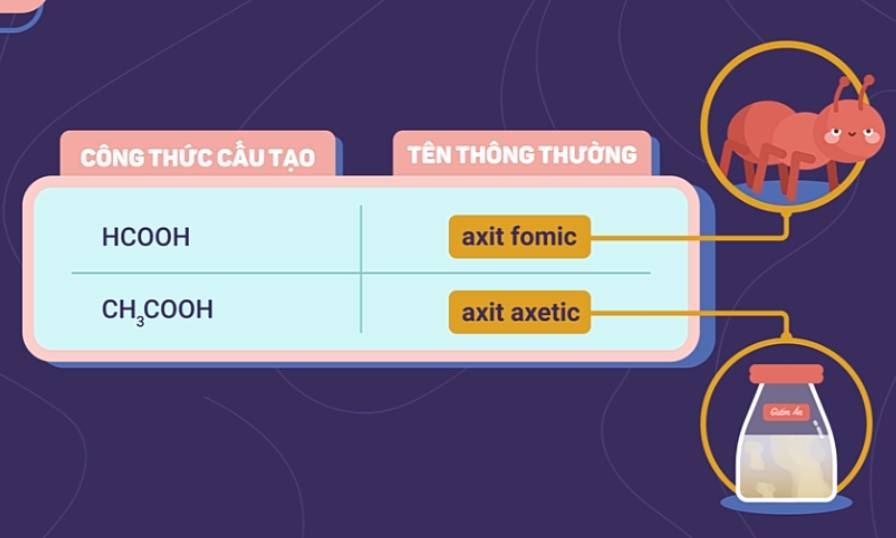
b) Tên thông thường
Một số axit hữu cơ tên thông thường bắt nguồn từ nguồn gốc tìm ra chúng nên không có tính hệ thống.
II. TÍNH CHẤT VẬT LÍ
- Các axit đều là chất lỏng hoặc rắn ở điều kiện thường.
- Nhiệt độ sôi của axit tăng dần theo chiều tăng của phân tử khối và cao hơn so với các ancol, anđehit, xeton tương ứng có cùng số nguyên tử cacbon. Nguyên nhân là do giữa các phân tử axit có liên kết hidro bền hơn liên kết hidro giữa các phân tử ancol còn anđehit và xeton không tạo được liên kết hidro.
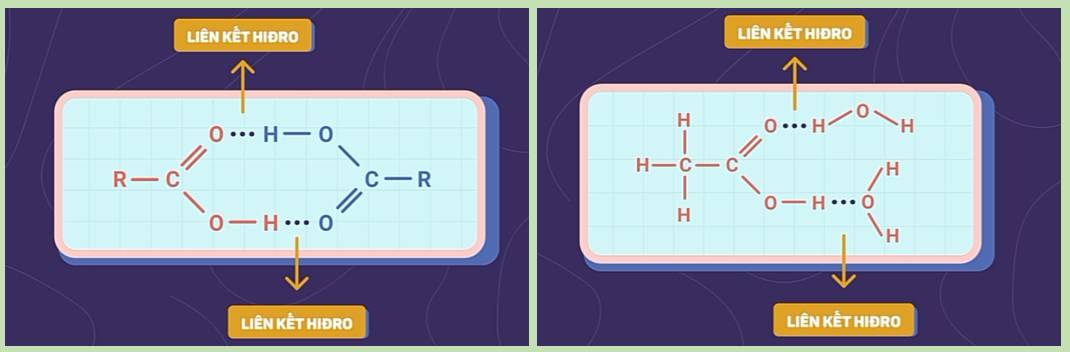
- Axit fomic HCOOH và axit axetic CH3COOH tan vô hạn trong nước. Độ tan trong nước của các axit giảm dần theo chiều tăng của phân tử khối.
- Mỗi axit đều có một vị riêng như axit axetic có vị giấm, axit oxalic có vị chua của me, axit xitric có vị chua của chanh...
III. ĐẶC ĐIỂM CẤU TẠO
Nhóm cacboxyl có cấu tạo như sau: 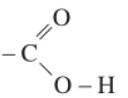
Ta thấy nhóm -COOH coi như được kết hợp bởi nhóm cacbonyl C=O và nhóm hidroxyl -OH nên nó được gọi là nhóm cacboxyl. Hai nhóm này có sự tương tác với nhau làm cho nhóm -OH ở phân tử axit cacboxyl linh động hơn nhóm -OH ở phân tử ancol, phenol và phản ứng ở nhóm C=O ở axit cũng không giống như của nhóm C=O anđehit, xeton.
Do đó, tính chất hóa học của axit cacboxylic là tính axit yếu.
IV. TÍNH CHẤT HÓA HỌC
Axit cacboxylic là những axit yếu. Tuy vậy, chúng có đầy đủ tính chất của một axit như : làm hồng quỳ tím, tác dụng với kim loại giải phóng hiđro, phản ứng với bazơ, đẩy được axit yếu hơn ra khỏi muối. Axit cacboxylic là những axit yếu. Tuy nhiên, chúng vẫn có đầy đủ tính chất của một axit như: làm hồng quỳ tím, tác dụng với kim loại giải phóng hidro, phản ứng với bazơ/oxit bazơ, đẩy axit yếu hơn ra khỏi muối.
1. Tính axit
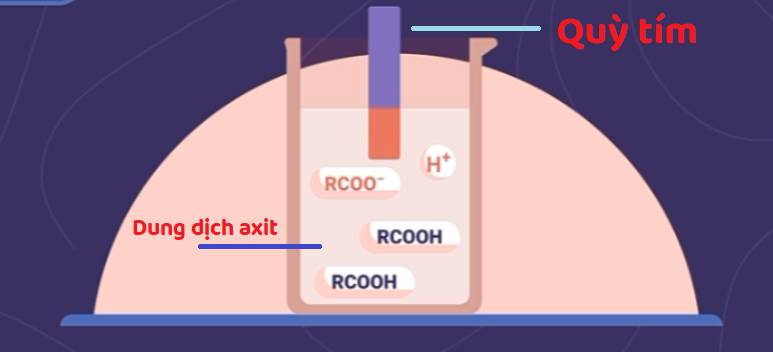
a) Sự phân li trong dung dịch
Nguyên tử H trong nhóm OH của axit cacboxylic khá linh động nên axit cacboxylic phân li không hoàn toàn trong nước theo cân bằng:
R-COOH ![]() R-COO- + H+
R-COO- + H+
Dung dịch axit cacboxylic làm quỳ tím chuyển màu đỏ.
b) Tác dụng với bazơ, oxit bazơ tạo thành muối và nước
HCOOH + NaOH → HCOONa + H2O
RCOOH + OH- → RCOO- + H2O
2CH3COOH + CaO → (CH3COO)2Ca + H2O
c) Tác dụng với muối
Axit axetic tác dụng với muối canxi cacbonat sinh ra muối mới, khí cacbonic CO2 và H2O
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
Thí nghiệm: Ngâm trứng gà trong dung dịch giấm ăn có thành phần là axit axetic.
.gif)
Hiện tượng: Có bọt khí thoát ra ở vỏ quả trứng, sau đó vỏ trứng bị hòa tan hoàn toàn. Nguyên nhân là do vỏ trứng có thành phần là muối canxi cacbonat CaCO3 nên đã phản ứng với axit axetic có trong giấm ăn như phương trình trên.
d) Tác dụng với kim loại đứng trước hidro trong dãy hoạt động hóa học
Axit cacboxylic tác dụng được với kim loại đứng trước hidro trong dãy hoạt động hóa học sinh ra khí H2
2CH3COOH + Zn → (CH3COO)2Zn + H2↑
.gif)
2. Phản ứng thế nhóm -OH
Axit cacboxylic phản ứng với ancol khi mặt chất xúc tác là axit H2SO4 đặc và đun nóng.
![]()
Ví dụ: CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Sản phẩm tạo thành gồm este và nước nên phản ứng trên được gọi là phản ứng este hóa. Phản ứng xảy ra thuận nghịch và cần axit H2SO4 đặc làm xúc tác.
V. ĐIỀU CHẾ
1. Phương pháp lên men giấm
Là phương pháp cổ truyền để sản xuất axit axetic, ngày này phương pháp này chỉ còn dùng để sản xuất giấm ăn với lượng nhỏ.
C2H5OH + O2 ![]() CH3COOH + H2O
CH3COOH + H2O
2. Oxi hóa anđehit axetic
Trước đây là phương pháp chủ yếu để sản xuất axit axetic:
2CH3CHO + O2 ![]() 2CH3COOH
2CH3COOH
3. Oxi hóa ankan
Oxi hóa các ankan mạch cacbon dài để tổng hợp các axit có phân tử khối lớn:
2R-CH2-CH2-R1 + 5O2 ![]() 2R-COOH + R1-COOH + H2O
2R-COOH + R1-COOH + H2O
Ví dụ: Oxi hóa butan thu được axit axetic.
2CH3CH2CH2CH3 + 5O2 ![]() 4CH3COOH + 2H2O
4CH3COOH + 2H2O
4. Từ metanol
Đây là phương pháp hiện đại để sản xuất axit axetic
CH3OH + CO ![]() CH3COOH
CH3COOH
Vì metanol và cacbon oxit đều được điều chế từ metan có sẵn trong khí thiên nhiên và khí dầu mỏ nên phương pháp này sản xuất được axit axetic với giá thành tốt nhất.
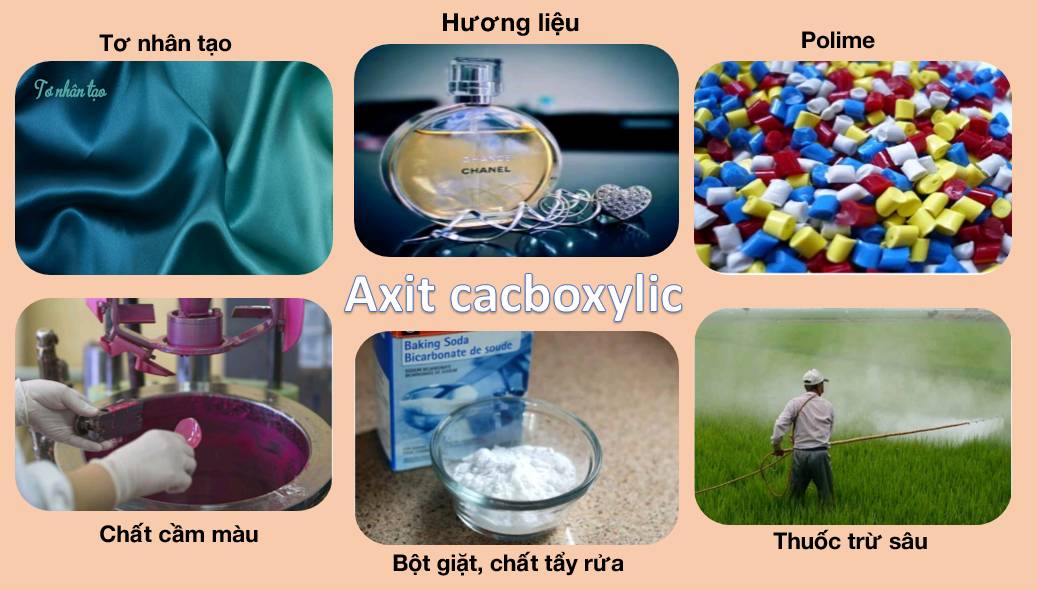
VI. ỨNG DỤNG
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cộng đồng Hoc24.vn cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây