Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. GIỚI THIỆU VỀ ANKEN
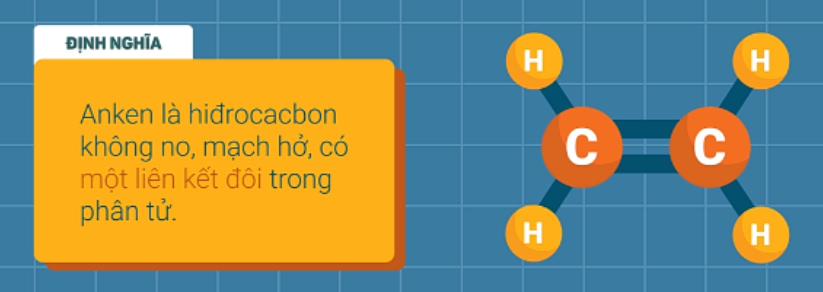
- Định nghĩa: Anken là hidrocabon không no, mạch hở, trong phân tử có chứa một liên kết đôi C=C.
- Công thức phân tử: CnH2n (n≥2).
II. ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP
1. Dãy đồng đẳng của anken
Etilen CH2=CH2 và các chất tiếp theo có công thức phân tử C3H6, C4H8, C5H10... trong phân tử có một liên kết đôi C=C và có tính chất tương tự nhau lập thành dãy đồng đẳng của anken có công thức phân tử chung là CnH2n (n≥2).

2. Đồng phân
a) Đồng phân cấu tạo
Tương tự ankan, các anken từ C4H8 trở đi, ứng với một công thức phân tử có các đồng phân anken về mạch cacbon. Ngoài ra, do trong phân tử có một liên kết đôi, các anken còn thêm đồng phân về vị trí liên kết đôi.
Ví dụ: Ứng với công thức anken C4H8 có các đồng phân ứng với công thức cấu tạo sau.

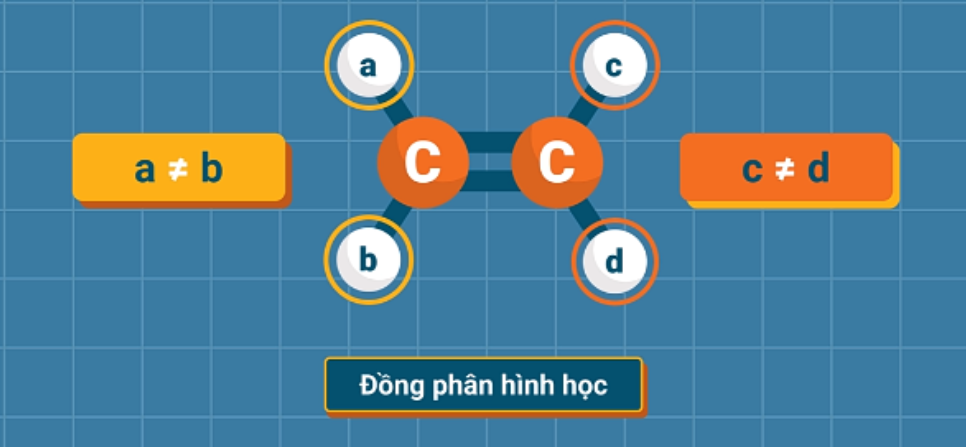
b) Đồng phân hình học
Những anken mà mỗi nguyên tử cacbon ở vị trí liên kết đôi liên kết với hai nhóm nguyên tử khác nhau sẽ có sự phân bố không gian khác nhau của mạch chính xung quanh liên kết đôi. Sự phân bố đó tạo ra đồng phân về vị trí không gian của nhóm nguyên tử gọi là đồng phân hình học.
Điều kiện để anken có tồn tại đồng phân hình học:
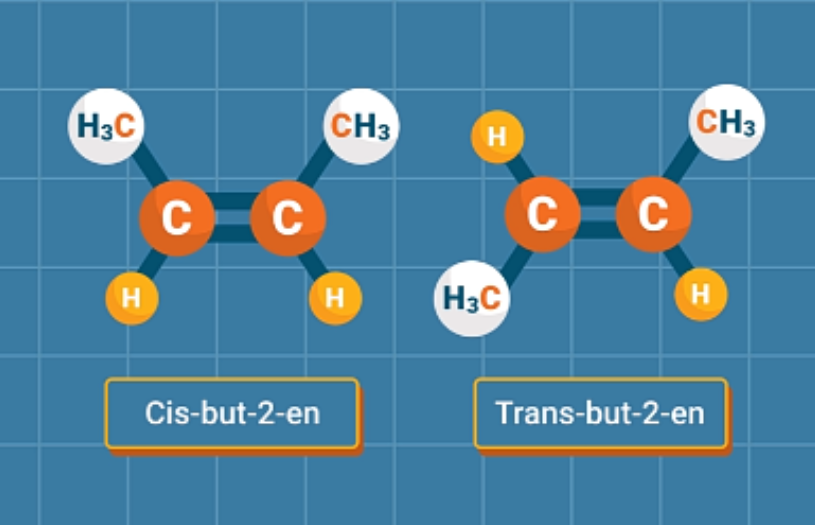
Đồng phân cis: Khi mạch chính nằm về cùng một phía của liên kết C=C.
Đồng phân trans: Khi mạch chính nằm ở hai phía khác nhau của liên kết C=C.
3. Danh pháp
a) Tên thông thường
Một số anken có tên thông thường.
Ví dụ: etilen C2H4, propilen C3H6, butilen C4H8.
| Tên thông thường = Tên thông thường ankan tương ứng sau khi đổi đuôi "an" thành đuôi "ilen". |
b) Tên thay thế
| Tên thay thế = Số chỉ vị trí của nhánh + tên nhánh + tên mạch chính + số chỉ liên kết đôi + "en". |
Quy tắc:
- Chọn mạch chính là mạch dài nhất chứa liên kết đôi.
- Đánh số mạch chính bắt đầu từ phía gần liên kết đôi nhất.
Ví dụ:
CH2=CH2: Eten.
CH2=CH-CH3: Propen.
CH3-CH=CH-CH(CH3)-CH3 : 4-metylpent-2-en.
III. TÍNH CHẤT VẬT LÝ
Ở điều kiện thường:
- Các anken từ C2H4 là chất khí,từ C5H10 trở đi là chất lỏng hoặc rắn.

- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng tăng dần theo chiều tăng của phân tử khối.

- Các anken đều nhẹ hơn nước và không tan trong nước.

III. TÍNH CHẤT HÓA HỌC
Liên kết đôi C=C gồm một liên kết σ và liên kết π . Liên kết π kém bền hơn liên kết σ nên dễ bị đứt ra khi tham gia phản ứng hóa học, gây nên tính chất hóa học đặc trưng của anken là dễ dàng tham gia phản ứng cộng tạo thành hợp chất no tương ứng.

1. Phản ứng cộng
- Cộng hidro
Khi có mặt niken (hoặc platin hoặc palađi) làm chất xúc tác, anken kết hợp với hidro tạo thành ankan tương ứng.
Ví dụ: CH2 = CH2 + H2 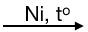 CH3-CH3
CH3-CH3
- Cộng halogen (dung dịch Br2)
Etilen và các đồng đẳng đều làm mất màu dung dịch brom do anken phản ứng với brom trong dung dịch.
Tổng quát: CnH2n + Br2 (dd) → CnH2nBr2
CH2=CH-CH3 + Br2 (dd) → CH2Br-CHBr-CH3
(màu nâu đỏ) (không màu)
Lưu ý: Phản ứng này dùng để phân biệt anken và ankan vì ankan không có khả năng làm mất màu dung dịch brom.
- Cộng HX (X là OH, Cl, Br,...)
Các anken tham gia phản ứng cộng với nước, hidro halogenua (HCl, HBr, HI), với các axit mạnh.
Ví dụ: CH2=CH2 + HCl → CH3-CH2-Cl
Đối với các anken có cấu tạo phân tử không đối xứng khi tác dụng với HX có thể sinh ra hỗn hợp hai sản phẩm.
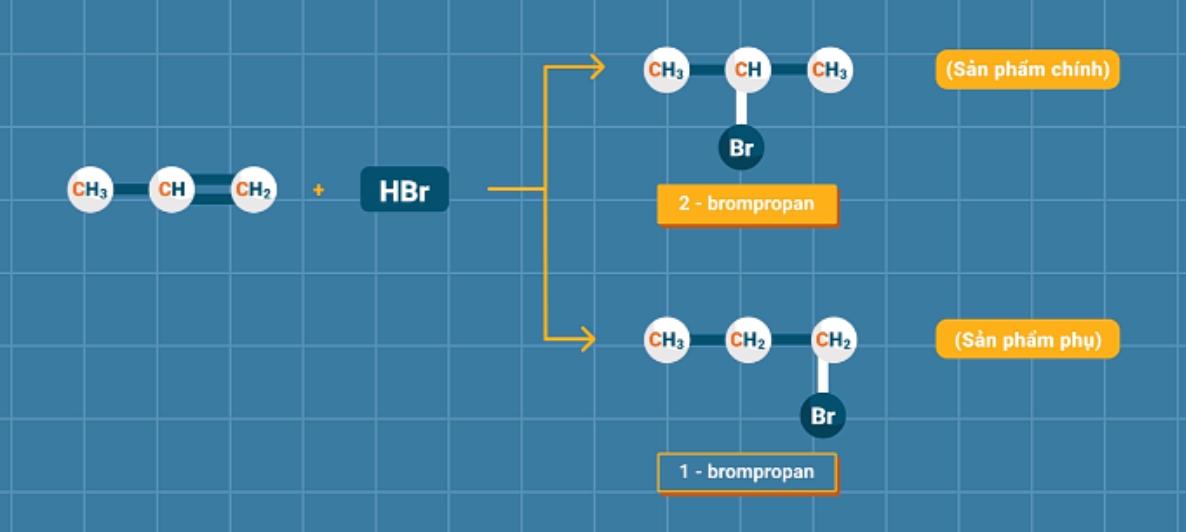
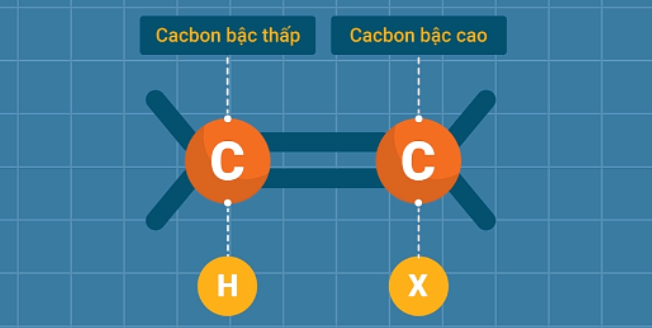
Để xác định đâu là sản phẩm chính trong phản ứng của anken bất đối xứng với HX, ta áp dụng quy tắc Mac-côp-nhi-côp: Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H ưu tiên cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn), còn nguyên tử hay nhóm nguyên tử X ưu tiên cộng vào nguyên tử cacbon có bậc cao hơn (ít H hơn).
2. Phản ứng trùng hợp
Ở nhiệt độ cao, áp suất cao và áp suất thích hợp, các phân tử anken có thể tự kết hợp với nhau tạo thành những phân tử có mạch rất dài và phân tử khối lớn.
... + CH2=CH2 + CH2=CH2 + CH2=CH2 + CH2=CH2 + ...  ...-CH2-CH2-CH2-CH2-CH2-CH2-...
...-CH2-CH2-CH2-CH2-CH2-CH2-...
Phản ứng trên có thể viết gọn như sau:
nCH2=CH2  -(-CH2-CH2-)-n
-(-CH2-CH2-)-n

Phản ứng trùng hợp là quá trình kết hợp liên kết nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành những phân tử rất lớn (gọi là polime).
CH2=CH2 được gọi là monome. Chất sản phẩm được gọi là polime, phần trong dấu ngoặc -CH2-CH2- được gọi là mắt xích polime, n là hệ số trùng hợp.
3. Phản ứng oxi hóa
- Phản ứng oxi hóa hoàn toàn
Khi bị đốt cháy, các anken đều cháy và tỏa nhiều nhiệt tương tự ankan.
CnH2n + \(\dfrac{3n}{2}\)O2 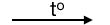 nCO2 + nH2O
nCO2 + nH2O
Phản ứng cháy anken: Số mol CO2 = số mol H2O.
- Phản ứng oxi không hoàn toàn
Etilen và các đồng đẳng làm mất màu dung dịch thuốc tím KMnO4. Phản ứng này cũng dùng để phân biệt anken và ankan.
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
IV. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Etilen được điều chế trong phòng thí nghiệm bằng cách đun nóng rượu etylic với H2SO4 đặc ở 170oC.
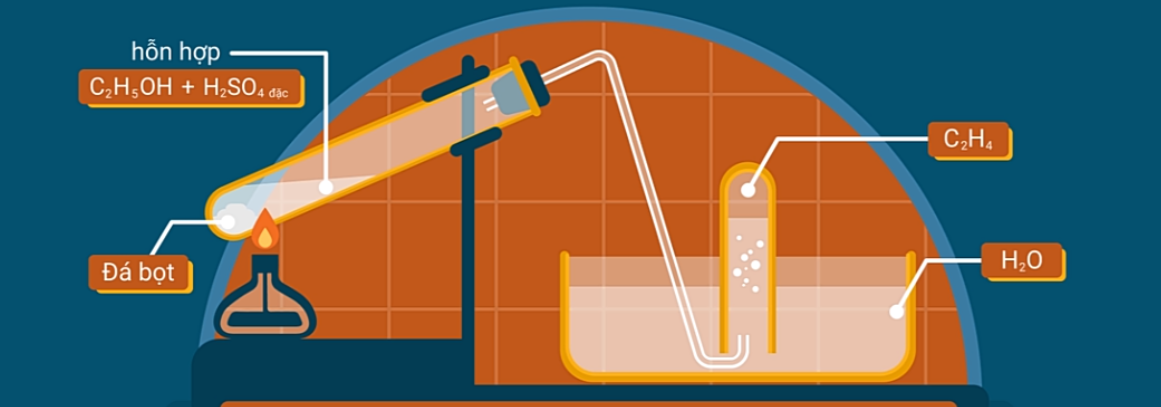
Tổng quát: CnH2n+1OH 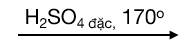 CnH2n + H2O
CnH2n + H2O
2. Trong công nghiệp
Các anken được điều chế từ ankan bằng phản ứng tách hidro:
CnH2n+2 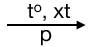 CnH2n + H2
CnH2n + H2
.gif)
V. ỨNG DỤNG
Các anken và dẫn xuất của anken là nguyên liệu cho nhiều quá trình sản xuất hóa học. Etilen, propilen, butilen dùng làm chất đầu để tổng hợp các polime có nhiều ứng dụng.

Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cộng đồng Hoc24.vn cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây