Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
A. KIẾN THỨC CẦN NẮM VỮNG
I. CẤU TẠO NGUYÊN TỬ VÀ PHÂN TỬ CỦA CÁC HALOGEN
- Các nguyên tử halogen đều có 7 electron lớp ngoài cùng.
- Về mặt kích cỡ, theo chiều từ flo đến iot, bán kính nguyên tử tăng dần.

- Phân tử được tạo từ 2 nguyên tử bằng liên kết cộng hóa trị không cực.
| Nguyên tố halogen | Flo | Clo | Brom | Iot |
| Cấu hình electron lớp ngoài cùng | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 |
| Cấu tạo phân tử (liên kết cộng hóa trị không cực) | F:F (F2) | Cl:Cl (Cl2) | Br:Br (Br2) | I:I (I2) |
II. TÍNH CHẤT HÓA HỌC
- Tính oxi hóa: Oxi hóa được hầu hết kim loại, nhiều phi kim và hợp chất.
- Độ âm điện và tính oxi hóa giảm dần từ flo đến iot.
| Nguyên tố halogen | Flo | Clo | Brom | Iot |
| Độ âm điện | 3,98 | 3,16 | 2,96 | 2,66 |
| Tính oxi hóa |
| |||
| Phản ứng với kim loại | Oxi hóa được tất cả kim loại tạo ra muối florua. | Oxi hóa được hầu hết các kim loại tạo ra muối clorua, phản ứng cần đun nóng. | Oxi hóa được nhiều kim loại tạo ra muối bromua, phản ứng cần đun nóng. | Oxi hóa được nhiều kim loại tạo ra muối iotua, phản ứng chỉ xảy ra khi đun nóng hoặc có mặt chất xúc tác |
| Phản ứng với hidro | Xảy ra ngay cả trong bóng tối, ở nhiệt độ rất thấp (-252oC) và nổ mạnh. F2 + H2 → 2HF | Phản ứng cần chiếu sáng để diễn ra, cũng gây nổ. Cl2 + H2 | Phản ứng chỉ xảy ra ở nhiệt độ cao. Br2 + H2 | Cần nhiệt độ cao hơn so với brom. I2 + H2 |
| Phản ứng với nước | Phản ứng mãnh liệt ngay ở nhiệt độ thường. 2F2 + 2H2O → 4HF + O2 | Phản ứng xảy ra ở nhiệt độ thường. Cl2 + H2O | Xảy ra ở nhiệt độ thường, chậm hơn so với clo. Br2 + H2O | Hầu như không tác dụng. |
III. TÍNH CHẤT HÓA HỌC CỦA HỢP CHẤT HALOGEN
1. Axit halogenhiđric
Dung dịch HF là axit yếu còn các dung dịch HCl, HBr, HI đều là các axit mạnh.

2. Hợp chất có oxi
Nước Gia-ven và clorua vôi (CaOCl2) có tính tẩy màu và sát trùng do muối NaClO và CaOCl2 đều là các chất có tính oxi hóa mạnh.
.gif)
.gif)
IV. PHƯƠNG PHÁP ĐIỀU CHẾ
| Flo | Điện phân hỗn hợp KF và HF. |
|
| Clo | Cho axit HCl tác dụng với các chất oxi hóa mạnh như MnO2, KMnO4... Điện phân dung dịch NaCl có màng ngăn. |
|
| Brom | Dùng Cl2 oxi hóa NaBr có trong nước biển thành Br2. |
|
| Iot | Sản xuất I2 từ rong biển. |
|
V. NHẬN BIẾT CÁC ION F-, Cl-, Br-, I-
Dùng dung dịch bạc nitrat AgNO3 làm thuốc thử.
| F- | Cl- | Br- | I- | |
| AgNO3 | Không tác dụng | Xuất hiện kết tủa trắng AgCl. NaCl + AgNO3 → AgCl↓ + NaNO3 | Xuất hiện kết tủa vàng nhạt AgBr. NaCl + AgNO3 → AgCl↓ + NaNO3 | Xuất hiện kết tủa màu vàng AgI. NaCl + AgNO3 → AgCl↓ + NaNO3 |

Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!


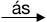 2HCl
2HCl 2HBr
2HBr 2HI
2HI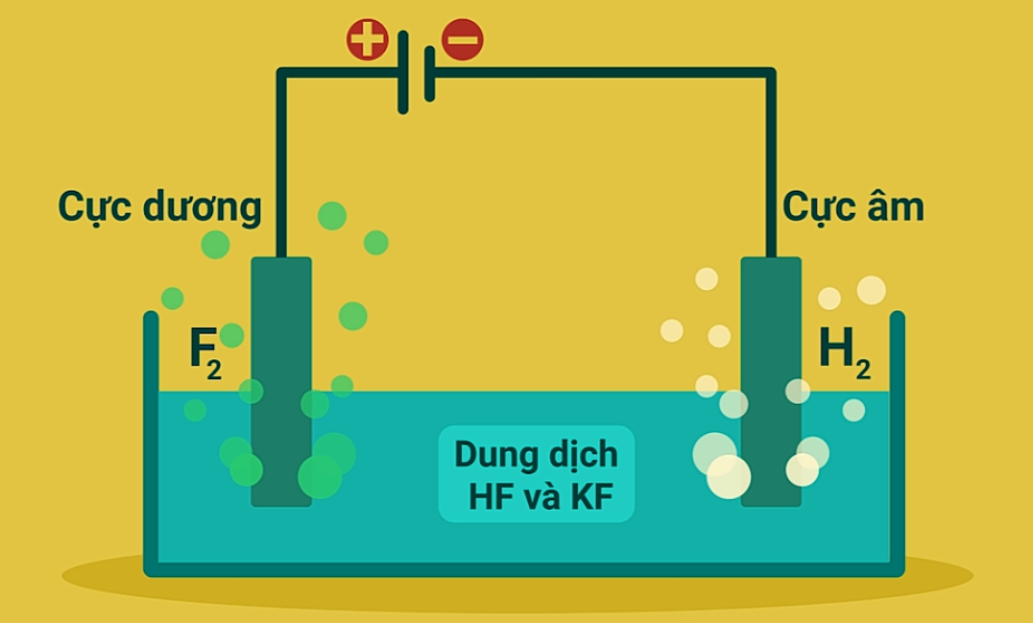
.gif)

.gif)
Bạn có thể đánh giá bài học này ở đây