Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
A. KIẾN THỨC CẦN NẮM
I. Lớp và phân lớp electron
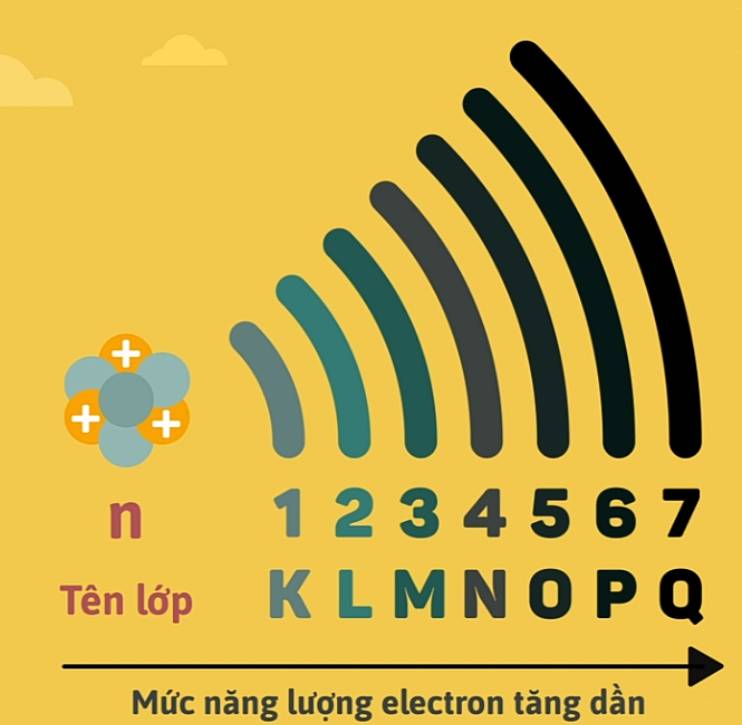
1. Lớp electron
- Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao và sắp xếp thành từng lớp.
- Các electron trên cùng một lớp có mức năng lượng gần bằng nhau.
2. Phân lớp electron
- Mỗi lớp electron lại chia thành các phân lớp.
- Số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
- Các electron ở phân lớp s được gọi là các electron s, ở phân lớp p được gọi là các electron p...
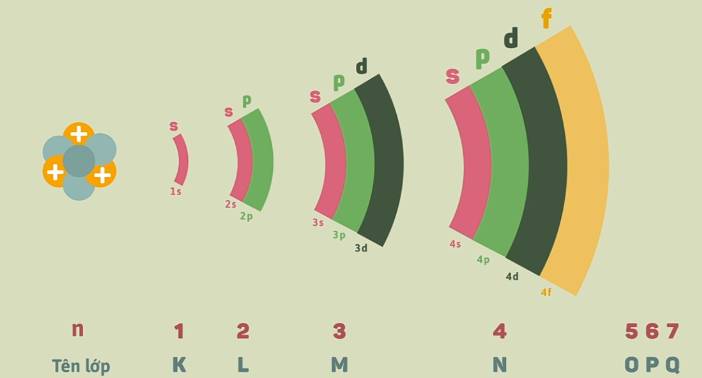
| Số thứ tự lớp | 1 | 2 | 3 | 4 | ... |
| Tên của lớp | K | L | M | N | ... |
| Số electron tối đa | 2 | 8 | 18 | 32 | ... |
| Số phân lớp | 1 | 2 | 3 | 4 | ... |
| Kí hiệu phân lớp | 1s | 2s, 2p | 3s, 3p, 3d | 4s, 4p, 4d, 4f | ... |
| Số electron tối đa ở phân lớp và ở lớp | 2 | 2, 6 (8) | 2, 6, 10 (18) | 2, 6, 10, 14 (32) | ... |
II. Mối liên hệ giữa lớp electron ngoài cùng với loại nguyên tố
- Đối với tất cả các nguyên tử của các nguyên tố, lớp electron ngoài cùng có tối đa là 8 electron.
- Các nguyên tử có 8 electron ở lớp ngoài cùng và nguyên tử heli (1s2) là các nguyên tử khí hiếm, không tham gia vào các phản ứng hóa học (trừ một số điều kiện đặc biệt) vì cấu hình electron của các nguyên tử này rất bền.
- Các nguyên tử có 1, 2, 3 electron lớp ngoài cùng dễ nhường electron là nguyên tử của các nguyên tố kim loại trừ (H, He và B).
- Các nguyên tử có 5, 6, 7 electron lớp ngoài cùng dễ nhận electron là nguyên tử của các nguyên tố phi kim.
- Các nguyên tử có 4 electron lớp ngoài cùng có thể là nguyên tử của các nguyên tố phi kim hoặc kim loại.
| Cấu hình electron lớp ngoài cùng | ns1, ns2, ns2np1 | ns2np2 | ns2np3, ns2np4 và ns2np5 | ns2np6 |
| Số electron thuộc lớp ngoài cùng | 1, 2 hoặc 3 | 4 | 5, 6 hoặc 7 | 8 (2 của He) |
| Loại nguyên tố | Kim loại (trừ H, He, B) | Có thể là kim loại, có thể là phi kim | Thường là phi kim | Khí hiếm |
| Tính chất cơ bản của nguyên tố | Tính kim loại | Có thể là tính kim loại, có thể là tính phi kim | Thường có tính phi kim | Tương đối trơ về mặt hóa học |
B. BÀI TẬP
Câu 1: Nguyên tử nguyên tố X có số hiệu nguyên tử là 17.
a. Viết cấu hình electron của nguyên tử nguyên tố X.
b. X là nguyên tố kim loại, phi kim hay khí hiếm? Vì sao?
a. 1s22s22p63s23p5
b. X là nguyên tố phi kim vì có 7 electron ở lớp ngoài cùng.
Câu 2: Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt.
a. Xác định số hiệu nguyên tử, số khối , viết kí hiệu của nguyên tử của nguyên tố X?
b. Viết cấu hình electron của X. Cho biết X là kim loại, phi kim hay khí hiếm ? Vì sao?
Lời giải
a. Ta có: 2Z + N = 40 và 2Z - N = 12
Giải hai phương trình ta được: Z = 13, N = 14.
Vậy kí hiệu nguyên tử của nguyên tố X là \(^{27}_{13}X\).
b. Cấu hình electron của X: 1s22s22p63s23p1
X là nguyên tố kim loại vì có 3 electron ở lớp ngoài cùng.
Bài 3. Nguyên tố đồng có hai đồng vị bền \(^{63}_{29}Cu\) và \(^{65}_{29}Cu\) .Biết nguyên tử khối trung bình của đồng là 63,54. Tính phần trăm hàm lượng của đồng vị 63Cu trong Cu(NO3)2 (cho O = 16, N = 14).
Lời giải
Gọi a là phần trăm số nguyên tử của đồng vị \(^{63}_{29}Cu\), b là phần trăm số nguyên tử của đồng vị \(^{65}_{29}Cu\).
Ta có: a + b = 100 (1)
Mà ACu = \(\overline{A}=\frac{aX+bY}{100}\)
⇔ 63,54 = \(\dfrac{63a+65b}{100}\) (2)
Giải hệ phương trình (1) và (2), ta được: a= 73; b=27.
Phần trăm hàm lượng của đồng vị 63Cu trong Cu(NO3)2 là:
%63Cu = \(\dfrac{63}{63,54+14.2+16.6}.100\%.\dfrac{73}{100}\) = 24,52%
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây