Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
PHẦN I - HÓA VÔ CƠ
I. KIẾN THỨC CẦN NHỚ
1. Mối liên hệ giữa các loại hợp chất vô cơ

2. Phản ứng hóa học thể hiện mối quan hệ
| Kim loại ⇌ Muối | Phi kim ⇌ Muối | Kim loại ⇌ Oxit bazơ |
Fe + 2HCl → FeCl2 Mg + Cu(NO3)2 → Mg(NO3)2 + Cu | 2Fe + 3Cl2 → 2FeCl3 2KClO3 | 2Cu + O2 H2 + ZnO |
| Phi kim ⇌ Axit | Oxit bazơ ⇌ Muối | Oxit axit ⇌ Muối |
Cl2 + H2O ⇌ HClO + HCl 6HCl + KClO3 → 3Cl2 + 3H2O + KCl | CaO + 2HCl → CaCl2 + H2O 2Cu(NO3)2 | CO2 + Ba(OH)2 → BaCO3 + H2O KHCO3 + HCl → KCl + CO2 + H2O |
II. BÀI TẬP
Bài 1. Viết phương trình hóa học hoàn thành sơ đồ chuyển hóa sau( ghi rõ điều kiện nếu có)
Al → Al2O3 → Al2(SO4)3 → Al(OH)3 →AlCl3
Hướng dẫn giải
4Al + 3O2 \(\underrightarrow{t^o}\) 2Al2O3
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Al2(SO4)3 + 3Ba(OH)2 → 2Al(OH)3 + 3BaSO4
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Bài 2. Thả một mảnh Cu vào các ống nghiệm có chứa các dung dịch sau:
a. AgNO3 b. H2SO4 loãng c. H2SO4 đăc, nóng d. MgSO4
Hướng dẫn giải
a. Có chất rắn màu trắng xám bám vào mảnh đồng dung dịch dần dần chuyển sang màu xanh đó là Cu(NO3)2.
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
b. Không có hiện tượng gì xảy ra vì Cu đứng sau H trong dãy hoạt động hóa học nên không phản ứng với dung dịch H2SO4 loãng.
c. Khi cho đồng vào H2SO4 đặc đun nóng có khí thoát ra, khí này có mùi hắc và dung dịch chuyển thành màu xanh đó là đồng sunfat CuSO4.
PTHH: Cu + 2H2SO4(đ,n) → CuSO4 + 2H2O + SO2
d. Không có hiện tượng gì xảy ra vì Cu đứng sau kim loại Mg trong dãy HĐHH nên không đẩy được Mg ra khỏi dung dịch muối.
Bài 3. Cho một khối lượng mạt sắt dư vào 50 ml dung dịch HCl. Phản ứng xong, thu được 3,36 lít khí (đktc).
a. Viết phương trình hóa học xảy ra.
b. Tính khối lượng mạt sắt đã tham gia phản ứng.
c. Tìm nồng độ mol của dung dịch HCl đã dùng.
Hướng dẫn giải
Số mol khí H2 = \(\dfrac{3,36}{22,4}\) = 0,15 mol
a. Phương trình phản ứng: Fe + 2HCl → FeCl2 + H2
0,15 0,3 0,15 0,15 (mol)
b. Khối lượng sắt đã phản ứng: mFe = 0,15 x 56 = 8,4 g
c. Số mol HCl phản ứng: nHCl = 0,3 mol, 50 ml = 0,05 lít
Nồng độ mol của dung dịch HCl: CM dd HCl = \(\dfrac{0,3}{0,05}\) = 6M.
Bài 4. Cho 13,5 gam kim loại M có hoá trị III tác dụng vói Cl2 dư thu được 66,75 gam muối . Hãy xác định kim loại đã dùng.
Hướng dẫn giải
Ta có PTTQ: 2M + 3Cl2 → 2MCl3
Theo định luật bảo toàn khối lượng ta có
Khối lượng của Cl2 cần dùng là: mCl2 = mmuối - mkim loại = 66,75 - 13,5 = 53,25 (g)
nCl2 = \(\dfrac{53,25}{71}\) = 0,75 mol => nkim loại = \(\dfrac{0,75.2}{3}\) = 0,5 mol
<=> Mkim loại = \(\dfrac{13,5}{0,5}\) = 27 g/mol.
Vậy kim loại M cần tìm là nhôm (Al).
PHẦN II - HÓA HỮU CƠ
I. KIẾN THỨC CẦN NHỚ
1. Công thức cấu tạo
| Metan (CH4) | Etilen (C2H4) | Axetilen (C2H2) | Benzen (C6H6) | Rượu etylic | Axit axetic |
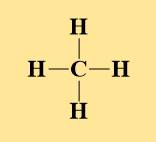 | 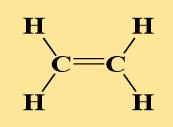 |  |  | CH3-CH2-OH | CH3-COOH |
2. Các phản ứng quan trọng
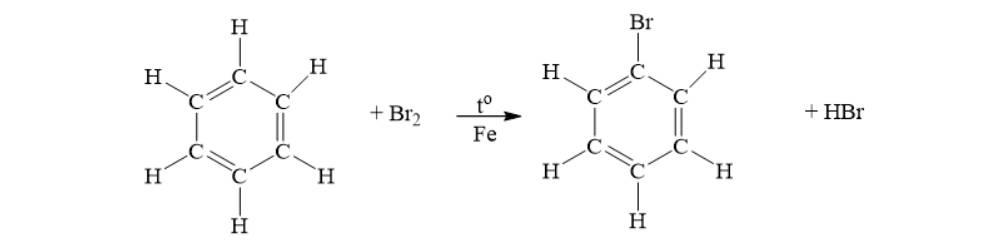
a. Phản ứng cháy của các hidrocacbon, rượu etylic. CH4 + 2O2 C2H4 + 3O2 2C2H2 + 5O2 C2H6O + O2 | b. Phản ứng thế của metan, benzen với clo, brom CH4 + Cl2
|
c. Phản ứng cộng của etilen và axetilen, phản ứng trùng hợp của etilen CH2=CH2 + H2 CH2=CH2 + Br2(dd) → CH2Br - CH2Br C2H2 + 2H2 C2H2 + H2 nCH2=CH2 | d. Phản ứng của rượu etylic, axit axetic với natri 2C2H5OH + 2Na → 2C2H5ONa + H2 2CH3COOH + 2Na → 2CH3COONa + H2 |
e. Phản ứng của axit axetic với kim loại, bazơ, oxit bazơ, muối 2CH3COOH + Zn → (CH3COO)2Zn + H2 2CH3COOH + CuO → (CH3COO)2Cu + H2O CH3COOH + NaOH → CH3COONa + H2O CH3COOH + KHCO3 → CH3COOK + CO2 + H2O | |
g. Phản ứng thủy phân chất béo, gluxit, protein (RCOO)3C3H5 + 3H2O (RCOO)3C3H5 + 3NaOH C12H22O11 + H2O -(-C6H10O5-)-n + nH2O Protein + nước | |
3. Các ứng dụng
| Hidrocacbon | Chất béo, gluxit, protein | Polime |
Là nguyên liệu quan trọng nhất để sản xuất nhiều loại hợp chất như chất dẻo, cao su, phẩm nhuộm, dược phẩm, polime PVC, PE, thuốc trừ sâu, thuốc nổ TNT... Dùng làm đèn xì oxi - axetilen. | Làm thực phẩm cho con người, là nguyên liệu để sản xuất các hợp chất hữu cơ phở biến như đường, rượu etylic. Dùng để sản xuất giấy, vải sợi làm quần áo, sản xuất đồ gỗ. | Polime được ứng dụng trong đời sống và kĩ thuật dưới các dạng khác nhau, phổ biến là chất dẻo, tơ, cao su. |
II. BÀI TẬP
Bài 1. Viết các phương trình hóa học thực hiện dãy chuyển hóa sau:
CH4 → C2H2 → C2H4 → CH3CH2OH → CH3COOH→ CH3COOC2H5
Hướng dẫn giải
2CH4 \(\underrightarrow{1500^oC}\) C2H2 + 3H2
C2H2 + H2 \(\underrightarrow{t^o,Pd}\) C2H4
C2H4 + H2O → CH3CH2OH
CH3CH2OH \(\underrightarrow{mengiam}\) CH3COOH
CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Bài 2. Có 3 lọ không nhãn đựng 3 dung dịch không màu: hồ tinh bột, glucozơ, saccarozo. Hãy nêu cách nhận biết các chất trên bằng phương pháp hóa học.
Hướng dẫn giải
Trích mẫu thử và đánh số thứ tự.
- Bước 1: Cho iot vào 3 dung dịch, dung dịch nào chuyển xanh là hồ tinh bột.
- Bước 2: Lấy 2 dung dịch còn lại cho vào ống nghiệm dung AgNO3 trong dung dịch amoniac, đun nóng. Ống nghiệm nào xuất hiện lớp Ag trắng sáng bám xung quanh thành ống nghiệm là glucozơ. Chất còn lại là saccarozo.
C6H12O6 + Ag2O → C6H12O7 + 2Ag
Bài 3. Đốt cháy hoàn toàn 16,8 gam hợp chất hữu cơ A thu được 52,8 gam khí CO2 và 21,6 gam H2O. Biết khối lượng mol của A là 56 g/mol.
a. Trong hợp chất hữu cơ A có những nguyên tố nào?
b. Tìm công thức phân tử của A.
Hướng dẫn giải
a.
mC = 52,8 : 44 x 12 = 14,4 (g); mH = 21,6 : 18 x 2 = 2,4 (g)
Ta có: mC + mH = 14,4 + 2,4 = 16,8 (g) = mA
Vậy A chứa hai nguyên tố: C và H
b.
Áp dụng công thức: \(\dfrac{12x}{m_C}=\dfrac{y}{m_H}=\dfrac{M_A}{m_A}\)
<=> \(\dfrac{12x}{14,4}=\dfrac{y}{2,4}=\dfrac{56}{16,8}\)
<=> x = \(\dfrac{14,4.56}{12.16,8}\) = 4
<=> y = \(\dfrac{2,4.56}{16,8}\) = 8
Vậy A có CTPT là C4H8.
Bài 4. Cho 12,5 gam hỗn hợp gồm Mg và Cu vào dd axit axetic có dư, sau phản ứng hoàn toàn thu được 10,08 lít khí không màu (đktc). Hãy tính khối lượng và phần trăm theo khối lượng mỗi chất trong hỗn hợp đầu.
Chỉ có Mg phản ứng được với dung dịch axit axetic theo phương trình:
Mg + 2CH3COOH → (CH3COO)2Mg + H2
nH2 = \(\dfrac{10,08}{22,4}\)= 0,45 mol
=> nMg = nH2 = 0,45 mol <=> mMg = 0,45 x 24 = 10,8 gam
=> %mMg = \(\dfrac{10,8}{12,5}\).100% = 86,4% <=> %mCu = 100 - 86,4 = 13,6%
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

 nC6H12O6
nC6H12O6
Bạn có thể đánh giá bài học này ở đây