Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. BIẾT CÔNG THỨC HÓA HỌC CỦA HỢP CHẤT, HÃY XÁC ĐỊNH THÀNH PHẦN PHẦN TRĂM THEO KHỐI LƯỢNG CỦA CÁC NGUYÊN TỐ TRONG HỢP CHẤT
Ví dụ 1:
Các bước tiến hành:
Bước 1: Tìm khối lượng mol của hợp chất.
M\(KNO_3\) = 39 + 14 + (16x3) = 101 g/mol.
Bước 2: Tìm số nguyên tử của mỗi nguyên tố có trong một 1 mol phân tử chất đó.
Trong 1mol phân tử KNO3 có:
| KNO3 | K | N | O |
| 1 mol | 1 mol | 1 mol | 3 mol |
Bước 3: Tính thành phần phần trăm theo khối lượng các nguyên tố trong hợp chất.
%mK = \(\dfrac{39.100\%}{101}\) = 38,6%
%mN = \(\dfrac{14.100\%}{101}\) = 13,8%
%mO = 100% - (38,6 + 13,8)% = 47,6%
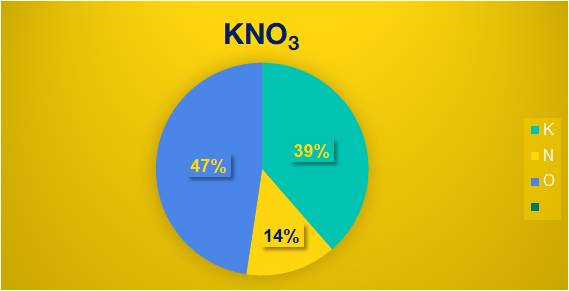
Thành phần phần trăm các nguyên tố của hợp chất KNO3.
Ví dụ 2: Một hợp chất hóa học có công thức là CaSO4, em hãy xác định thành phần phần trăm (theo khối lượng) của các nguyên tố.
Bước 1: Tìm khối lượng mol của hợp chất.
M\(CaSO_4\) = 40 + 32 + (16 x 4) = 136 g/mol.
Bước 2: Tìm số nguyên tử của mỗi nguyên tố có trong một 1 mol phân tử chất đó.
| CaSO4 | Ca | S | O |
| 1 mol | 1 mol | 1 mol | 1 mol |
Bước 3: Tính thành phần phần trăm theo khối lượng các nguyên tố trong hợp chất.
%mCa = \(\dfrac{40.100\%}{136}\) = 29,4%
%mS = \(\dfrac{32.100\%}{136}\) = 23,5%
%mO = 100% - (29,4 + 23,5)% = 47,1%

Thành phần phần trăm các nguyên tố của hợp chất CaSO4.
2. BIẾT THÀNH PHẦN CÁC NGUYÊN TỐ, HÃY XÁC ĐỊNH CÔNG THỨC HÓA HỌC CỦA HỢP CHẤT
Ví dụ 1:
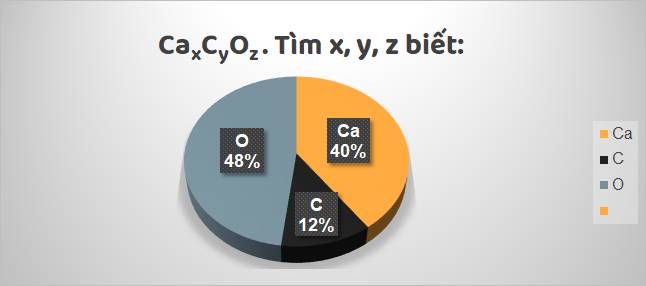
Các bước tiến hành:
| Bước 1: Tìm khối lương của mỗi nguyên tố có trong 1 mol hợp chất. | Bước 2: Tìm số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất |
mCa = 100 x 40% = 40 gam mC = 100 x 12% = 12 gam mO = 100 x 48% = 48 gam | nCa = \(\dfrac{40}{40}\) = 1 mol nC = \(\dfrac{12}{12}\) = 1 mol nO = \(\dfrac{48}{16}\) = 3 mol |
⇒ Trong 1 phân tử hợp chất đó có: 1 nguyên tử Ca, 1 nguyên tử C, 3 nguyên tử O.
⇒ Công thức hóa học của hợp chất là: CaCO3.
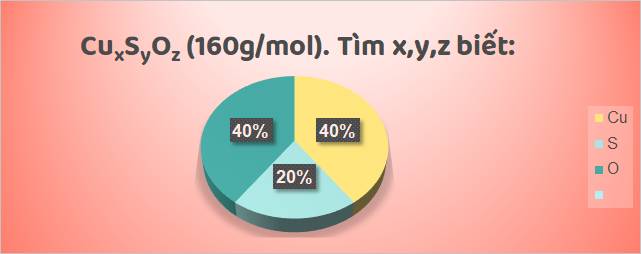
Các bước tiến hành:
| Bước 1: Tìm khối lương của mỗi nguyên tố có trong 1 mol hợp chất. | Bước 2: Tìm số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất |
mCu = 160 x \(\dfrac{40}{100}\) = 64 gam mS = 160 x \(\dfrac{20}{100}\) = 32 gam mO = 160 - (64 + 32) = 64 gam | nCu = \(\dfrac{64}{64}\) = 1 mol nS = \(\dfrac{32}{32}\) = 1 mol nO = \(\dfrac{64}{16}\) = 4 mol |
⇒ Trong 1 phân tử hợp chất đó có: 1 nguyên tử Cu, 1 nguyên tử S, 4 nguyên tử O.
⇒ Công thức hóa học của hợp chất là: CuSO4.
Các bước tiến hành:
1. Biết công thức hóa học, tìm thành phần các nguyên tố:
Tìm khối lượng mol của hợp chất, tìm số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất → tìm thành phần theo khối lượng của mỗi nguyên tố.
2. Biết thành phần các nguyên tố, tìm công thức hóa học:
Tìm số mol nguyên tử của mỗi nguyên tố trong hợp chất → lập công thức hóa học của hợp chất.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây