Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Các yếu tố ảnh hưởng tới tốc độ phản ứng SVIP
1. Ảnh hưởng của nồng độ tới tốc độ phản ứng
- Khi tăng nồng độ chất phản ứng cũng đồng thời làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
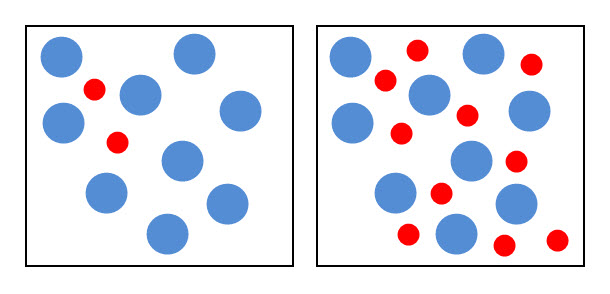
Hình: Bên trái biểu thị nồng độ thấp, bên phải biểu thị nồng độ cao
2. Ảnh hưởng của nhiệt độ tới tốc độ phản ứng
- Khi tăng nhiệt độ cũng đồng thời làm tăng tốc độ chuyển động của các phân tử chất dẫn đến làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
Hình: Sự chuyển động của phân tử chất ở nhiệt độ thấp (bên trái) và nhiệt độ cao (bên phải).
- Kết quả từ thực nghiệm cho biết, khi nhiệt độ tăng lên 10oC, tốc độ của phần lớn các phản ứng tăng từ 2 đến 4 lần. Số lần tăng lên này được gọi là hệ số nhiệt độ Van't Hoff.
- Hệ số nhiệt độ Van't Hoff:
+ Kí hiệu: γ
+ Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hoá học được biểu diễn bằng công thức:
\(\dfrac{v_{t_2}}{v_{t_1}}=\gamma^{\dfrac{t_2-t_1}{10}}\)
Trong đó: \(v_{t_1},v_{t_2}\) là tốc độ phản ứng ở 2 nhiệt độ \(t_1,t_2.\)
\(\gamma\) là hệ số nhiệt độ Van't Hoff.
3. Ảnh hưởng của áp suất tới tốc độ phản ứng
- Đối với phản ứng hoá học có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
Hình: Các phân tử khí ở nhiệt độ thấp (bên trái) và nhiệt độ cao (bên phải).
4. Ảnh hưởng của bề mặt tiếp xúc tới tốc độ phản ứng
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
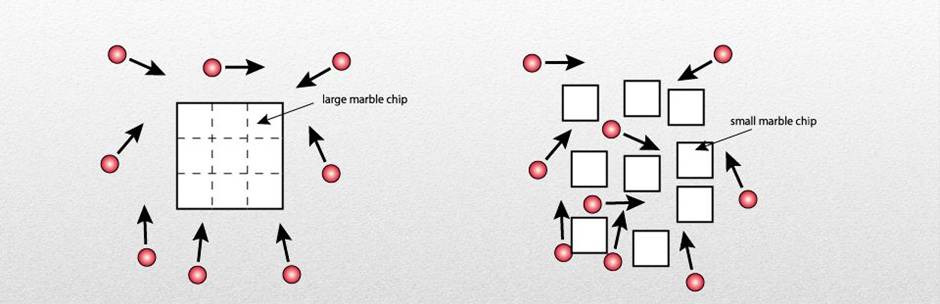
Hình: Sự va chạm của các phân tử chất khi diện tích tiếp xúc lớn hơn (bên phải).
5. Ảnh hưởng của chất xúc tác tới tốc độ phản ứng
- Với một số phản ứng hoá học, để tăng tốc độ phản ứng, người ta sử dụng chất xúc tác được ghi trên mũi tên trong phương trình hoá học.
- Chất xúc tác làm tăng tốc độ của phản ứng hoá học, nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng.
6. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
Việc kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất khi vận dụng các yếu tố ảnh hưởng như: nồng độ, nhiệt độ, áp suất, bề mặt tiếp xúc và chất xúc tác giúp mang lại các giá trị hiệu quả.
1. Khi tăng nồng độ chất phản ứng cũng đồng thời làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
2. Khi tăng nhiệt độ cũng đồng thời làm tăng tốc độ chuyển động của các phân tử chất dẫn đến làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
3. Đối với phản ứng hoá học có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
4. Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
5. Với một số phản ứng hoá học, để tăng tốc độ phản ứng, người ta sử dụng chất xúc tác được ghi trên mũi tên trong phương trình hoá học.
6. Việc kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất khi vận dụng các yếu tố ảnh hưởng như: nồng độ, nhiệt độ, áp suất, bề mặt tiếp xúc và chất xúc tác giúp mang lại các giá trị hiệu quả.



Bạn có thể đánh giá bài học này ở đây