Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Liên kết hydrogen và tương tác Van der Waals SVIP
I. LIÊN KẾT HYDROGEN
1. Tìm hiểu về liên kết hydrogen
- Nguyên nhân gây ra sự khác nhau về nhiệt độ sôi của phân tử H2S và H2O: H2S có kích thước phân tử lớn hơn nhưng nhưng nhiệt độ sôi của hợp chất này là -60\(℃\), thấp hơn nhiều so với nước là 100\(℃\). Nguyên nhân là do sự phân cực khác nhau của liên kết trong mỗi phân tử.
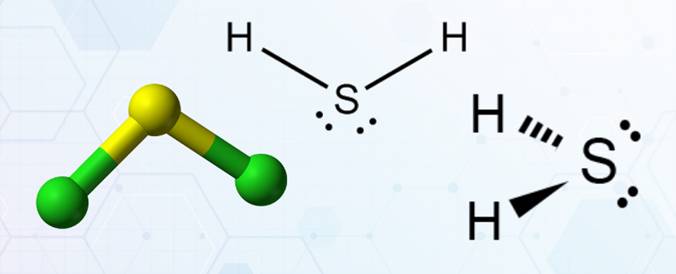
Phân tử H2S
Phân tử H2O
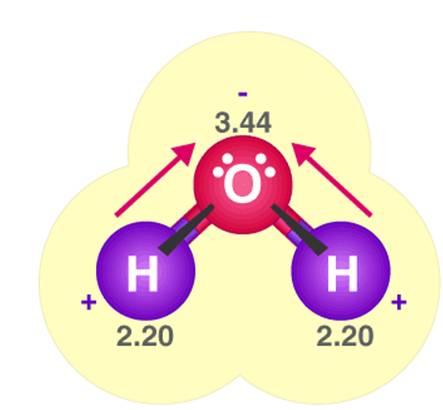
- Giữa các phân tử H2O có một liên kết yếu được tạo thành do lực hút tĩnh điện giữa nguyên tử H mang một phần điện tích dương của phân tử H2O này với nguyên tử O mang một phần điện tích âm của phân tử H2O khác. Liên kết này là liên kết hydrogen, thường được biểu diễn bằng dấu ba chấm (…).
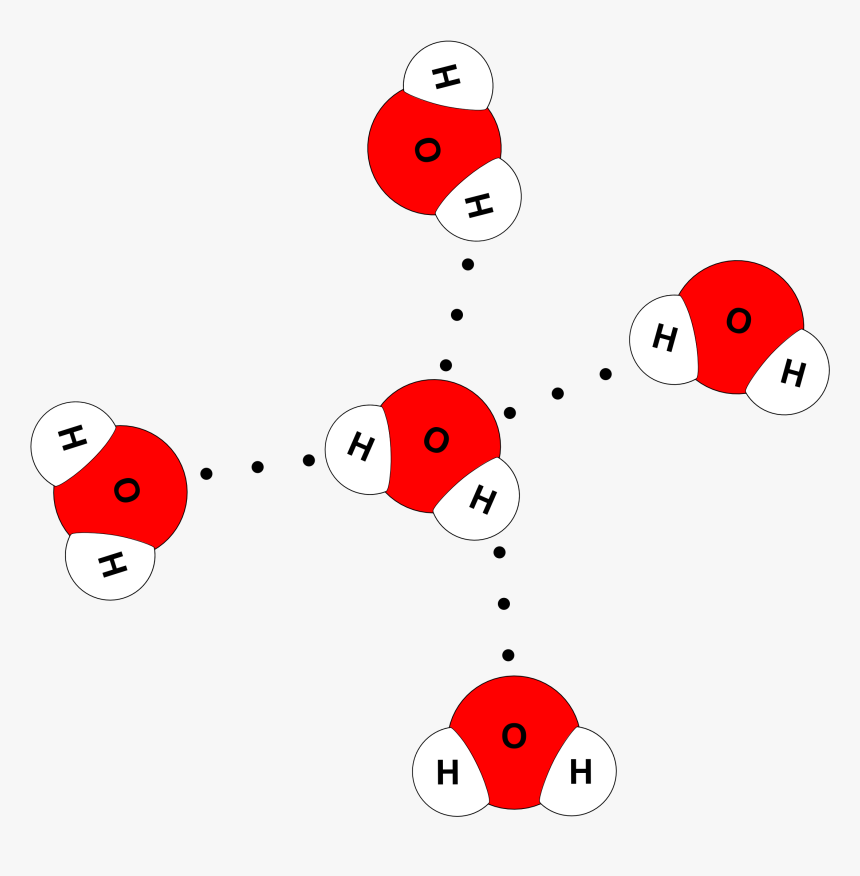
Liên kết hydrogen trong phân tử H2O
Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hoá trị chưa tham gia liên kết.
2. Vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
- So với các hợp chất có cùng cấu trúc phân tử nhưng không hình thành được liên kết hydrogen
- Các hợp chất có liên kết hydrogen đều có nhiệt độ sôi cao hơn do tạo được liên kết hydrogen liên phân tử.
VD: H2O và H2S có cấu trúc phân tử tương tự nhau. Nhưng H2O do tạo được liên kết hydrogen nên có nhiệt độ sôi và nhiệt độ nóng chảy lớn hơn nhiều so với H2S không tạo được liên kết hydrogen.
- Các hợp chất có liên kết hydrogen tan tốt hơn trong nước do tạo được liên kết hydrogen với các phân tử nước.
VD: H2O là một dung môi tốt. Không chỉ hoà tan được nhiều hợp chất ion, mà còn hoà tan được nhiều hợp chất cộng hoá trị phân cực.
- Nước ở trạng thái rắn có thể tích lớn hơn khi ở trạng thái lỏng. Đó là do nước đá có cấu trúc tinh thể phân tử với bốn phân tử H2O phân bố ở bốn đỉnh của một tứ diện đều, bên trong là cấu trúc rỗng. Nên nước đá nổi được trên mặt nước lỏng.
Nhờ có liên kết hydrogen mà ở điều kiện thường nước ở thể lỏng có nhiệt độ sôi cao (100oC).
II. TƯƠNG TÁC VAN DER WAALS
1. Giới thiệu về tương tác van der Waals
- Trong phân tử các electron không ngừng chuyển động. Khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các lưỡng cực tạm thời.
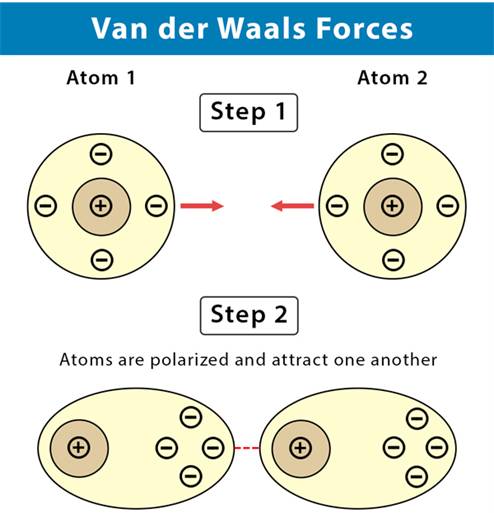
Tương tác Van der Waals
- Các phân tử có lưỡng cực tạm thời cũng có thể làm các phân tử lân cận xuất hiện các lưỡng cực cảm ứng. Do đó các phân tử có thể tập hợp thành một mạng lưới với các tương tác lưỡng cực cảm ứng, được gọi là tương tác van der Waals.
Tương tác van der Waals là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các lưỡng cực tạm thời và lưỡng cực cảm ứng.
2. Tìm hiểu ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy và nhiệt độ sôi của các chất

Tương tác Van der Waals của Ne
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
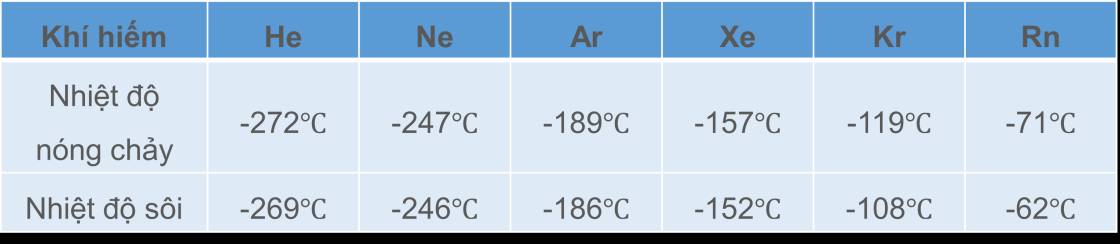
Bảng: Nhiệt độ sôi và nhiệt độ nóng chảy của các khí hiếm
Các em đã học
1. Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hoá trị chưa tham gia liên kết.
2. Các hợp chất có liên kết hydrogen đều có nhiệt độ sôi cao hơn do tạo được liên kết hydrogen liên phân tử.
Các hợp chất có liên kết hydrogen tan tốt hơn trong nước do tạo được liên kết hydrogen với các phân tử nước.
3. Tương tác van der Waals là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các lưỡng cực tạm thời và lưỡng cực cảm ứng.
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.

Bạn có thể đánh giá bài học này ở đây