Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Cấu tạo của bảng tuần hoàn các nguyên tố hoá học SVIP
I. Lịch sử phát minh
- D. I. Mendeleev (1834 – 1907), nhà khoa học người Nga, ông được coi là cha đẻ của bảng tuần hoàn các nguyên tố hóa học. Dù trước đó cũng đã có một số nhà khóa học tìm hiểu về tính tuần hoàn nhưng chưa có ai đưa ra được một công trình có tính hệ thống như Mendeleev.
- Mendeleev nhận thấy có mối liên hệ giữa khối lượng nguyên tử và tính chất các nguyên tố tương ứng. Ông đã sắp xếp chúng vào một bảng với khối lượng nguyên tử tương ứng như sau:
|
Cl = 35,5 |
Br = 80 |
I =127 |
|
K = 39 |
Rb = 85,4 |
Cs = 133 |
|
Ca = 40 |
Sr = 87,6 |
Ba = 137 |
- Sau đó bằng cách thêm các nguyên tố khác nhau theo mô hình này. Mendeleev đã đưa ra công bố về phiên bản mở rộng của bảng tuần hoàn vào năm 1869, bao gồm tất cả các nguyên tố đã biết và nhiều dự đoán về nguyên tố mới.
- Năm 1871, Mendelev đưa ra định luật tuần hoàn phát biểu như sau: ”Tính chất của các đơn chất, cấu tạo và tính chất các hợp chất của chúng có tính tuần hoàn theo khối lượng nguyên tử khối của các nguyên tố”. Nhờ định luật này ông đã dự đoán được 10 nguyên tố mới. Trong đó có 3 nguyên tố được tiên đoán khá tỉ mỉ về tính chất và hợp chất của chúng (sau này là nguyên tố Sc, Ga và Ge).
- Bảng tuần hoàn hiện đại ngày nay được xây dựng dựa trên cơ sở sử dụng mối liên hệ “số hiệu nguyên tử - tính chất” thay vì “khối lượng nguyên tử - tính chất” như của Mendeleev.
II. Nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học được sắp xếp vào một bảng, gọi là bảng tuần hoàn dựa trên 3 nguyên tắc sau:
- Các nguyên tố hóa học được sắp xếp từ trái sang phải và từ trên xuống dưới theo chiều tăng dần điện tích hạt nhân nguyên tử.
- Các nguyên tố mà nguyên tử có cùng số lớp electron được xếp vào cùng một hàng.
- Các nguyên tố mà nguyên tử có cùng số electron hóa trị như nhau được xếp vào cùng một cột.
Lưu ý: Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học.
Electron hóa trị = số electron lớp ngoài cùng + số electron phân lớp sát lớp ngoài cùng (nếu phân lớp đó chưa bão hòa)
Ví dụ: Xác định cấu hình electron và số electron hóa trị của các nguyên tố sau
O (Z=8) 1s22s22p4 ⇒ có 6 electron hóa trị
Ca (Z=18) 1s22s22p63s23p64s2 ⇒ có 1 electron hóa trị
Ti (Z=22) 1s22s22p63s23p63p24s2 ⇒ có 4 electron hóa trị
Fe (Z=26) 1s22s22p63s23p63p64s2 ⇒ có 8 electron hóa trị
III. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tử
- Mỗi ô nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn, gọi là ô nguyên tố.
- Mỗi ô nguyên tố chưa một số thông tin của một nguyên tố hóa học như: kí hiệu nguyên tố, tên nguyên tố, số hiệu nguyên tử,…
- Số thứ tự ô = số hiệu nguyên tử.
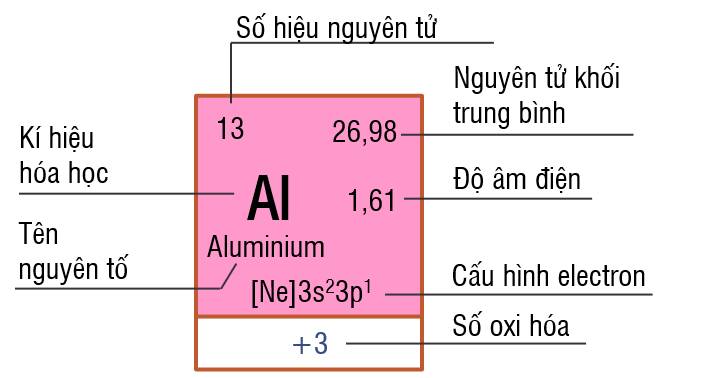
Ô nguyên tố Aluminium
2. Chu kì
- Chu kì là tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cùng số lớp electron, được xếp thành hàng theo chiều tăng dần điện tích hạt nhân từ trái sang phải.
- Bảng tuần hoàn gồm 7 chu kì, được đánh số thứ tự từ 1 đến 7.
- Số thứ tự chu kì = số lớp electron.
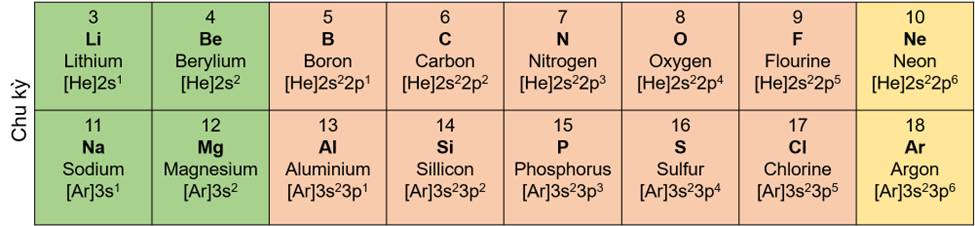
Các nguyên tố thuộc chu kì 2 và 3
3. Nhóm
- Nhóm là tập hợp các nguyên tố hóa học mà nguyên tử có cấu hình electron tương tự nhau, được xếp thành cột theo chiều tăng dần điện tích hạt nhân từ trên xuống dưới.
- Bảng tuần hoàn gồm 18 cột, được chia thành 8 nhóm A, đánh số từ IA đến VIIIA; 8 nhóm B, được đánh số từ IB đến VIIIB. Mỗi nhóm A hay B đều chỉ có một cột, trừ nhóm VIIIB có ba cột.
IV. Liên hệ giữa cấu hình electron nguyên tử với vị trí của nguyên tố trong bảng tuần hoàn
- Từ cấu hình electron nguyên từ của một nguyên tố hóa học, ta có thể xác định được vị trí của nguyên tố trong bảng tuần hoàn theo quy tắc sau:
Số thứ tự của ô nguyên tố = số hiệu nguyên tử.
Số thứ tự của chu kì = số lớp electron nguyên tử.
Nguyên tố nhóm A có cấu electron lớp ngoài cùng dạng ns1÷2 hoặc ns2np1÷6 và nguyên tố nhóm B có cấu hình electron lớp ngoài cùng và sát lớp ngoài cùng dạng (n – 1)d1÷10ns1÷2.
Ví dụ:
Cấu hình electron của nguyên tử Chlorine là 1s22s22p63s23p5, từ cấu hình này xác định được vị trí của Chlorine trong bảng tuần hoàn:
- Số hiệu nguyên tử của Cl là 17, do đó nguyên tố Cl nằm ở ô số 17.
- Nguyên tử Cl có 3 lớp electron, nên Cl thuộc chu kì 3.
- Cấu hình electron lớp ngoài cùng của Cl là 3s23p5 có 7 electron nên nguyên tố Cl thuộc nhóm VIIA.
V. Phân loại nguyên tố hóa học
1. Dựa theo cấu hình electron
Dựa vào cấu hình electron nguyên tử, người ta phân loại các nguyên tố hóa học thành các nguyên tố s, p, d, f.
Nguyên tố s là nguyên tố nhóm A mà nguyên tử có cấu hình electron lớp ngoài cùng là ns1÷2.
Nguyên tố p là nguyên tố nhóm A mà nguyên tử có cấu hình electron lớp ngoài cùng là ns2np1÷6.
Nguyên tố d là nguyên tố nhóm B mà nguyên tử có cấu hình electron phân lớp ngoài cùng và phân lớp sát lớp ngoài cùng là (n – 1)d1÷10ns1÷2.
Nguyên tố f là nguyên tố nhóm B mà nguyên tử có cấu hình electron phân lớp ngoài cùng và phân lớp sát lớp ngoài cùng là (n – 2)f0÷14(n – 1)d10ns2. Các nguyên tố f được xếp riêng bên dưới bảng tuần hoàn.
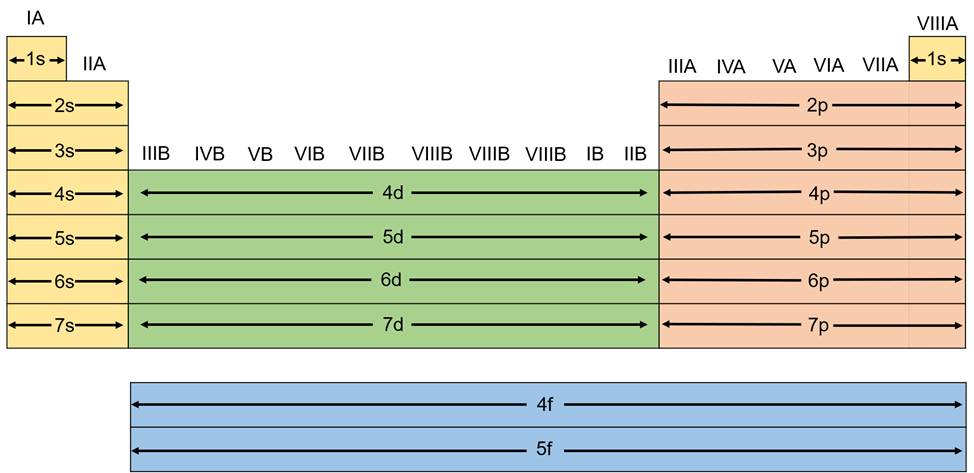
Các khối nguyên tố s, p, d, f trong bảng tuần hoàn
2. Dựa theo tính chất hóa học
- Các nguyên tố hóa học còn có thể được phân loại dựa theo tính chất hóa học cơ bản. Dựa vào cách này các nguyên tố được chia thành: phi kim, kim loại và khí hiếm.

Bạn có thể đánh giá bài học này ở đây