Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Xu hướng biến đổi thành phần và tính chất của hợp chất trong một chu kì SVIP
I. THÀNH PHẦN CỦA CÁC OXIDE VÀ HYDROXIDE
Hóa trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen tăng từ I đến VII khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố flourine ở chu kì 2), do đó thành phần của các oxide và hydroxide có sự lặp lại theo chu kì.
Công thức oxide, hydroxide ứng với hóa trị cao nhất của nguyên tố chu kì 3 được trình bày trong bảng sau:
|
Nhóm |
Oxide |
Hydroxide |
|
IA |
Na2O |
NaOH |
|
IIA |
MgO |
Mg(OH)2 |
|
IIIA |
Al2O3 |
Al(OH)3 |
|
IVA |
SiO2 |
H2SiO3 |
|
VA |
P2O5 |
H3PO4 |
|
VIA |
SO3 |
H2SO4 |
|
VIIA |
Cl2O7 |
HClO4 |
II. TÍNH CHẤT CỦA OXIDE VÀ HYDROXIDE
- Các oxide khi tác dụng với nước tạo thành hyrdoxide có tính base hoặc acid. Sự biến đổi về tính base và acid theo chu kì và nhóm của các nguyên tố nhóm A được biểu diễn trong hình ảnh sau:
|
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cr2O7 |
|
basic oxide |
basic oxide |
oxide lưỡng tính |
acidic oxide |
acidic oxide |
acidic oxide |
acidic oxide |
|
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
|
base mạnh |
base yếu |
hydroxide lưỡng tính |
acid yếu |
acid trung bình |
acid mạnh |
acid rất mạnh |
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
Ví dụ 1: Phản ứng của oxide với nước
Cho lần lượt các oxide Na2O, MgO và P2O5 vào nước, nhúng giấy quỳ tím vào trong các ống nghiệm sau phản ứng.
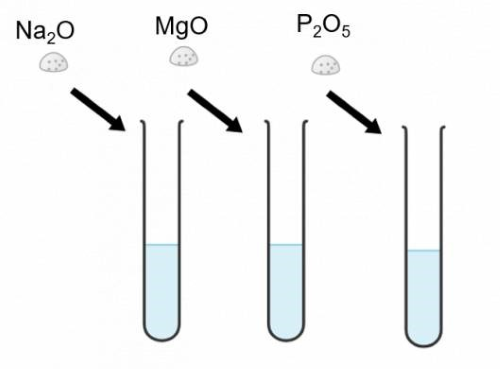
Kết quả thu được của thí nghiệm được thể hiện qua hình ảnh sau
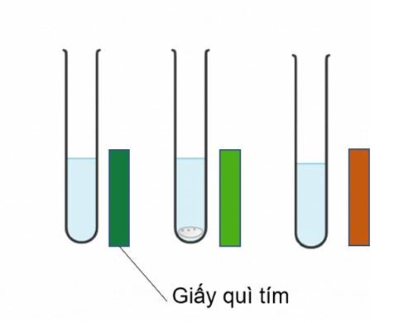
Các oxide trên khi tác dụng với nước tạo dung dịch hydroxide, nhúng giấy quì tím vào giấy quì tím sẽ đổi màu tùy theo tính acid và tính base của dung dịch. Dung dịch có tính base mạnh quì tím sẽ chuyển màu xanh đậm, tính base yếu thì giấy quì có màu xanh nhạt và dung dịch có tính acid thì quì tím sẽ chuyển sang màu đỏ.
Ví dụ 2: Phản ứng của muối với dung dịch axit
Nhỏ từng giọt dung dịch HCl vào ống nghiệm chứa dung dịch Na2CO3.
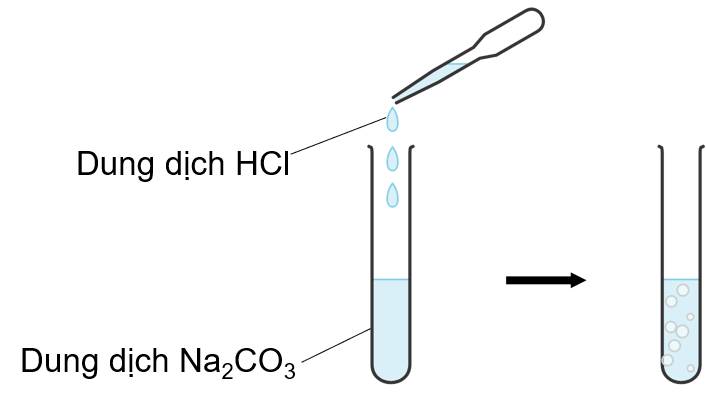
Hiện tượng: Dung dịch có xuất hiện bọt khí
Phương trình hóa học: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Tính acid của acid H2CO3 yếu hơn so với tính acid của acid HCl. Do đó, acid HCl có thể tác dụng với dung dịch muối Na2CO3 tạo ra muối NaCl và acid H2CO3. Acid H2CO3 yếu và kém bền do đó bị phân hủy tạo khí CO2 và H2O. Điều này dẫn đến có xuất hiện bọt khí trong ống nghiệm khi phản ứng xảy ra.
Trong một chu kì: theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.

Bạn có thể đánh giá bài học này ở đây